
|
|
無機化学。 チートシート: 簡単に言えば、最も重要なこと
目次
1.体内の代謝とエネルギーのプロセス間の関係。 熱力学系 地球上の生命プロセスは主に、生体物質(タンパク質、脂肪、炭水化物)への太陽エネルギーの蓄積と、エネルギーの放出による生体内でのこれらの物質のその後の変換によるものです。 A. M. Lavoisier (1743-1794) と P. S. Laplace (1749-1827) の作品は、生命の過程で放出されるエネルギーが、動物が吸入した空気中の酸素による食品の酸化によって決定されることを直接熱量測定によって示しました。 XIX-XX世紀の発展とともに。 熱力学により、生化学反応におけるエネルギー変換を定量的に計算し、その方向を予測することが可能になりました。 熱力学的方法は、「システム」、「システムの状態」、「システムの内部エネルギー」、「システムの状態の機能」など、いくつかの厳密な概念に基づいています。 熱力学系 十分に多数の分子 (構造単位) で構成され、実数または仮想の境界面 (界面) によって他の自然界のオブジェクトから分離された、任意の自然のオブジェクトが呼び出されます。 システムに含まれていない自然のオブジェクトは、環境と呼ばれます。 システムの最も一般的な特性は、m - システムに含まれる物質の質量、および E - システムの内部エネルギーです。 系の物質の質量は、それを構成する分子の総質量によって決まります。 系の内部エネルギーは、分子の熱運動のエネルギーと分子間の相互作用のエネルギーの合計です。 環境との物質とエネルギーの交換の性質に応じたシステムは、孤立、閉鎖、開放のXNUMXつのタイプに分けられます。 隔離されたシステム 物質やエネルギーを媒体と交換しないシステムが呼び出されます(Δm= 0、ΔE= 0)。 閉鎖系とは、環境と物質を交換しないが、エネルギーを交換できるシステムです(Δm= 0、ΔE^ 0)。 エネルギーは、熱を移動したり、仕事をしたりすることで交換できます。 オープンシステム 物質とエネルギーの両方を媒質と交換できるシステムと呼ばれます (Δm ≠ 0、ΔE ≠ 0)。 開放系の重要な例は生細胞です。 システムは、構成されている物質の凝集状態に応じて、均一系と不均一系に分けられます。 均質なシステムでは、システムのある領域から別の領域に移動するときに、物理的および化学的特性に急激な変化はありません。 このようなシステムの例は、さまざまな生体物質の溶液である血漿です。 異種システムは、XNUMX つ以上の同種の部分で構成されます。 不均一系の例は、全血、つまり赤血球や白血球などの細胞を含む血漿です。 2. 熱力学の第一法則。 システムを特徴付ける概念 熱力学の第一法則は、さまざまなシステムのエネルギーを分析するための厳密な定量的枠組みを提供します。 それを定式化するには、システムを特徴付ける多くの新しい概念を導入する必要があります。 最も重要な概念の XNUMX つは、システムの状態です。 状態は、熱力学の観点からシステムを定義することを可能にするシステムの一連のプロパティとして理解されます。 システムの状態の一般化された特性として、「平衡」、「定常」、「遷移状態」という概念が使用されます。 システムの状態は、すべての特性が長期間にわたって一定のままであり、システム内に物質とエネルギーの流れがない場合、平衡と呼ばれます。 システムの特性が時間的に一定であるが、物質とエネルギーの流れがある場合、その状態は定常と呼ばれます。 状態は、熱力学変数を使用して定量的に区別されます。 熱力学変数は、システム全体の状態を特徴付ける量です。 これらはシステムの熱力学的パラメータとも呼ばれます。 最も重要な熱力学的変数は、圧力 p、温度 T、システムの体積 V またはシステムの総質量 m、システムを構成する化学物質 (成分) の質量 mk、またはこれらの物質の濃度です。 医師は患者の状態を判断するために同様の特性(体温、体重、体液の組成、血圧)を使用することに注意してください。 ある状態から別の状態へのシステムの遷移は、 プロセス別. プロセスの結果として、システムの状態と熱力学的変数が変化します。 初期状態での熱力学的変数の値を X と表すと、1 そして最後に - X2 の場合、この変数の変化はそれぞれ ΔX = X に等しくなります。2 - NS1 と呼ばれ、熱力学的変数 X の増分と呼ばれます。反対の符号で取られた増分は、変数 X の減少と呼ばれます。 システム E の内部エネルギーは、状態の熱力学的関数の XNUMX つです。 状態関数の重要な特徴は、システムの特定の状態を達成する方法から独立していることです。 システムの内部エネルギーの変化 ΔE は、システムと環境との相互作用中に実行される仕事 W と、環境とシステムの間の熱交換 Q によるものであり、これらの量の比率は熱力学第一法則の内容。 あるプロセスでのシステムの内部エネルギーの増加 ΔE は、システムが受け取った熱 Q に、このプロセスでシステムで行われた仕事 W を加えたものに等しくなります。: ΔE=Q+W。 生物学的システムでは、通常、熱はシステムによって外部環境に放出され、内部エネルギーの損失によりシステムによって仕事が行われます。 熱力学の第一法則の数学的記録を次の形式で表すと便利です。 ΔE = Q - W。 上記の式のすべての量は、ジュール (J) で測定されます。 3.熱力学の第一法則 熱力学の第XNUMX法則は、他の法則から導き出すことのできない自然の基本法則のXNUMXつです。 その有効性は、多くの実験、特に、第XNUMX種の永久機関、つまり外部からエネルギーを供給せずに任意の時間動作できる機械を構築する試みの失敗によって証明されています。 システム内のプロセスの条件に応じて、熱力学の第一法則から導かれるさまざまな状態関数が使用されます。 同時に、複雑な生物学的システムの代わりに、簡略化されたモデルを使用して、質量とエネルギーの変換に関する結論を得ることができます。 システム内の圧力は一定に保たれ、外部圧力と等しくなります。 p = const で発生するこのようなプロセスは、等圧と呼ばれます。 等圧プロセスで行われる膨張作業は、次のように知られています。 W = ρΔV、 ここで、ΔV はシステムの体積増分であり、状態 2 と 1 の体積の差に等しくなります。 展開の作業を第 XNUMX 法則の数式に置き換え、単純な変換を実行すると、次のようになります。 Qρ = ΔE + pΔV = (E2 +ρV2) - (E1 +ρΔV1) ここで、Qρ は等圧過程の熱です。 1、2 - プロセスの開始と終了に関連するインデックス。 値 (E + pV) は、システムの状態の関数であり、H で示され、エンタルピーと呼ばれます。 H = E + ρV。 したがって、式は次のように記述できます。 Qp = H2 -H1 = ∆H。 この式から、次のようになります。 エンタルピー - 状態関数。その増分は、等圧プロセスでシステムが受け取った熱に等しくなります。 あるプロセスにおけるエンタルピー増分の測定は、このプロセスを熱量計で一定圧力で実施することによって実施することができる。 A. M. Lavoisier と P. S. Laplace はまさにこの方法で実験を行い、生体内の代謝のエネルギー論を研究しました。 システムの状態の変化が一定の量で発生する場合、そのプロセスはアイソコリックと呼ばれます。 この場合、体積変化 AV はゼロに等しく、式によれば、膨張仕事 W = 0 です。次に、熱力学の第一法則の数式から次のようになります。 Qv = ΔE。 熱力学的定義は、上記の関係から次のようになります。 内部エネルギー - 状態関数。その増分は、等容性プロセスでシステムによって取得された熱 QV に等しくなります。 したがって、あるプロセスにおける内部エネルギーの変化は、このプロセスを熱量計で一定体積で実行することによって測定できます。 ρ = const では、内部エネルギーとエンタルピーの増分は次の関係によって関連付けられます。 ΔH = ΔE + ρΔV。 4. ヘスの法則 化学反応におけるエネルギーの変換を研究する熱力学のセクションは、化学熱力学と呼ばれます。 内部エネルギーの変化ΔE、エンタルピーΔH、またはこの反応に対応する他の状態関数が示される反応方程式は、熱化学と呼ばれます。 システムのエンタルピーが減少し(ΔH<0)、熱が外部環境に放出される化学反応は、 発熱. エンタルピーが増加し (ΔH > 0)、システムが熱 Q を吸収する反応p 外で呼ばれる 吸熱. 酸素によるグルコースの酸化は、大量の熱の放出とともに起こります (Qp = 2800 kJ/ /mol)、つまり、このプロセスは発熱です。 対応する熱化学方程式は次のように記述されます。 С6 Н12 О6 + 602 = 6С02 +6Н2ああ、ΔH = 2800 kJ。 溶液中で起こる反応は、通常、系の体積のわずかな変化、すなわち ΔV ≒ 0 を伴います。この点に関して、多くの場合、生物学的計算では、ΔH = ΔE と仮定できます。 その結果、そのようなシステムでの熱の放出は、主に反応の結果としての内部エネルギーの減少によるものであり、逆もまた同様です。 化合物Aの生成エンタルピーは、システムのエンタルピーの変化ΔHです。A 単体から 1 mol の化合物 A を生成する。 酸素、炭素、水素、およびその他すべての元素 (単純) 物質の生成エンタルピーはゼロであると想定されます。 他の条件が同じであれば、内部エネルギーとエンタルピーはシステム内の物質量に比例します。 このような熱力学的機能は広範囲と呼ばれます。 熱力学の観点から、一般的な形式nの反応AA + pВ = nС +いいえD 、Δh は、エンタルピー H の初期状態からのシステムの遷移です。1 エンタルピー H で状態 2 へ2. この反応のエンタルピーと呼ばれる、この遷移の結果としてのシステムのエンタルピーの変化は、差に等しくなります。 ΔHpya = H2 -H1 =(ncHc +いいえDHD) - (nАНА +いいえBHB). 熱和不変の法則は、1840 年にロシアの化学者 G. I. ヘスによって発見されました。彼は、化学変換における熱力学の第一法則の適用可能性の発見者であり、化学熱力学の創始者です。 現在、ヘスの法則は熱力学の第一法則の結果と考えられており、次のように定式化されています。これらの製品の。 熱化学計算では、より頻繁に使用されるのはヘスの法則自体ではありませんが、その結果は、等式の形でのグルコース酸化の特定のケースについて上記で導き出されます(2)。 一般的な形式で提示される反応の場合pАA + pвB = = nсC + nDD、ヘスの法則の結果は、等式 ΔH を使用して記述されます。pya =(nCΔHC +いいえDΔHD) - (nAΔHA ++nBΔHB )そして次のように定式化されます: 反応エンタルピーは、化学量論量の生成物の生成エンタルピーの代数的合計から、化学量論量の反応物の生成エンタルピーの代数的合計を引いたものに等しくなります。 5.熱力学の第二法則。 ギブズの自由エネルギー 人体は、その構成物質の原子の化学的相互作用のエネルギーの形で蓄えられた内部エネルギーを消費することによって仕事を行います。 熱力学第 XNUMX 法則の数式 ΔE = Q - W は、システムの内部エネルギー消費 ΔE、システムによって実行される仕事 W、および熱の形で失われるエネルギー Q の間の正確な関係を決定します。 しかし、熱力学の第一法則からは、消費された内部エネルギーのうち仕事に変換できる部分を決定することは不可能です。 理論上のコストの見積もりは、熱力学の第 XNUMX 法則に基づいています。 この法則は、エネルギーを仕事に変換する効率に厳しい制限を課し、さらに、プロセスの自発的な流れの可能性に関する基準を導入することを可能にします。 プロセスは呼び出されます 自発、それが何の影響もなく実行された場合、システムがそれ自体に任されている場合。 システムの内部エネルギーが変化しないプロセスがあります(ΔE= 0)。 このようなプロセスには、例えば、水中での酢酸のイオン化が含まれる。 多くの自発的プロセスは、内部エネルギーの増加とともに進行します(ΔE> 0)。 これには、特に、アルブミン(血漿タンパク質)とCuなどの金属イオンとの生物無機化合物の形成の典型的な反応が含まれます。2+. 閉鎖系の内部エネルギー AE の変化は、自発的なプロセスの基準としては機能しません。 したがって、この基準が導き出される熱力学の第一法則は、自発性の問題やプロセスの効率性の問題を解決するには不十分です。 これらの問題の解決は、熱力学の第二法則の助けを借りて達成されます。 熱力学の第二法則を定式化するには、熱力学的な意味での可逆プロセスと不可逆プロセスの概念を導入する必要があります。 システムが平衡状態にある場合、この状態は同じ外部条件下で無期限に維持されます。 外部条件が変化すると、システムの状態が変化する可能性があります。つまり、システム内でプロセスが発生する可能性があります。 初期状態 1 から最終状態 2 への遷移中に、すべての中間状態が平衡状態にある場合、プロセスは熱力学的に可逆的であると言われます。 中間状態の少なくとも XNUMX つが非平衡である場合、プロセスは熱力学的に不可逆的であると呼ばれます。 可逆プロセスは、システムのパラメータ(温度、圧力、物質の濃度など)を十分にゆっくりと変化させた場合にのみ実行できます。パラメータの変化率は、プロセス中に生じる平衡からの逸脱が無視できる程度でなければなりません。 可逆性は、低温での組織の保存という重要な医学的問題に関連していることに注意する必要があります。 可逆プロセスは、自然界で発生し、産業または実験室で実行される実際のプロセスの限定的なケースです。 6. 熱力学の第二法則。 エントロピ 最大仕事Wмакс状態1から状態2への遷移の過程で内部エネルギーΔEの所与の損失で得ることができる、は、この過程が可逆的である場合にのみ達成されます。 熱力学の第XNUMX法則の式に従って、最小熱Q分 Q分 \uXNUMXd ΔE - Wмакс . システムの内部エネルギーのコスト効率を特徴付ける達成可能な最大効率係数は、それぞれ次のようになります。 ηмакс=Wмакс /ΔE。 状態 1 から状態 2 への不可逆的な移行プロセスでは、システムが行う仕事は W 未満です。 最大係数 h を計算するにはмакс ΔE の値が既知の場合、W の値を知る必要があります。макс または Q分 Wмакс =ΔE-Q分 、したがって、ηмакс = 1 - ΔE / Q分 . Q値分 エントロピーと呼ばれる熱力学的状態関数を使用して、熱力学の第 XNUMX 法則から計算できます。 エントロピーの概念は、熱力学と熱過程の分子動力学理論の創設者の1865人であるドイツの物理学者R. Yu。Clausius(1822-1888)によって導入されました(XNUMX)。 クラウジウスによるエントロピーの熱力学的定義:エントロピーは、増分ΔSが熱Qに等しい状態関数です。分 プロセスが実行される絶対温度 T で割った、可逆的な等温プロセスでシステムにもたらされます。 ΔS = Q分 /T。 式から、エントロピーの単位はJ/Kであることがわかります。 可逆的な等温プロセスの例は、273°K の水で魔法瓶内の氷をゆっくりと溶かすことです。 1モルの氷(18g)を溶かすには少なくとも6000Jの熱を供給する必要があることが実験的に証明されています。 この場合、魔法瓶内の氷水系のエントロピーは ΔS = 6000 J: 273°K = 22 J/K だけ増加します。 水を入れた魔法瓶を 273°K で冷却すると、6000 J の熱がゆっくりと除去され、水の結晶化中に 1 mol の氷が形成されます。 このプロセスでは、Q分 式に負の値が含まれています。 したがって、1 モルの氷が形成されるときの氷水系のエントロピーは、ΔS = 22 J/K だけ減少します。 同様に、これらのプロセス中にシステムに供給される熱またはシステムから除去される熱がわかっている場合、等温の物理的および化学的プロセスのエントロピーの変化を計算することができます。 物理学から知られているように、この熱は熱量測定を使用して決定できます。 したがって、エントロピーの変化、および系の状態の他の XNUMX つの関数 (内部エネルギーとエンタルピー) は実験的に決定される量です。 エントロピーと内部エネルギーの物理的意味は、分子動力学の観点から孤立系で発生するプロセスを考慮すると明確に明らかになります。 7. ボルツマンの公式 孤立したシステムは、定義上、物質もエネルギーも環境と交換しません。 もちろん、そのようなシステムは自然界には存在しません。 ただし、コルクで密封された魔法瓶にシステムを配置することで、非常に優れた断熱性を実現できます。 自発的なプロセスは、エントロピーの増加によって特徴付けられる場合にのみ、孤立したシステムで発生することがわかります。 平衡では、システムのエントロピーは一定です。 ∆S≥0。 実験的観察に基づくこのステートメントは、熱力学の第 XNUMX 法則の可能な定式化の XNUMX つです。 熱力学の第 XNUMX 法則によれば、自然現象とは逆のプロセスは、孤立したシステムでは進行できません。これは、そのようなプロセスがエントロピーの減少によって特徴付けられるためです。 さまざまな孤立したシステムの調査は、自発的なプロセスが常にシステムのマイクロステート w の数の増加に関連付けられていることを示しています。 同じプロセスで、システムのエントロピー S が増加します。つまり、エントロピーはマイクロステートの数の増加とともに増加します。 このような依存関係の存在は、1872 年にこの関係を提案したオーストリアの物理学者 L. ボルツマンによって初めて注目されました。 КБ =R/NA = 1,38-1023 J/K、 ここでKБ - ボルツマン定数、気体定数 R とアボガドロ定数 N の比に等しいA . この関係はボルツマン方程式と呼ばれます。 ボルツマンの式を使用すると、システムのエントロピーを可能なマイクロステートの数から理論的に計算することができます。 このような計算は、実験的に決定された値とよく一致しています。 特に、0°K における結晶性物質のミクロ状態の数は w に近いことが知られています。0 「1.したがって、相対値のみを決定できる内部エネルギーEおよびエンタルピーHとは対照的に、結晶化物質のエントロピーの絶対値を決定できます。 多くの場合、システムのマイクロステートの数の増加は、システムのエネルギーのより可能性の高い分布への移行を伴う、このシステムの無秩序の増加に関連付けることができます。 ボルツマンの関係に基づいて、エントロピーの分子動力学的定義を与えることができます。 エントロピーは、システムが特定の状態にある確率の尺度、またはシステムの無秩序の尺度です。 エントロピーの概念の重要性は、この値に基づいて自発的なプロセスの方向を予測することが可能であるという事実によるものです。 ただし、プロセスの方向の基準としてエントロピーを測定することの適用性は、熱力学の第二法則の定式化に従って、孤立したシステムに限定されます。 8.ギブスエネルギー 開いたシステムと閉じたシステムにおけるプロセスの自発性の基準として、新しい状態関数であるギブス エネルギーが導入されます。 この関数は、この関数を導き出し、熱力学の研究で使用した偉大なアメリカの物理学者 D. W. ギブス (1839 ~ 1903 年) にちなんで名付けられました。 ギブス エネルギーは、エンタルピー H とエントロピー S の関係を使用して決定されます。 G = H-S、 ∆G = ∆H-∆S。 ギブズ エネルギーに基づいて、熱力学の第 XNUMX 法則は次のように定式化できます。 等圧等温条件下(p、T = const)では、そのようなプロセスのみがシステム内で自発的に発生し、その結果、システムのギブズエネルギーが減少します(ΔG<0)。平衡状態では、ギブズエネルギーはシステムは変更されません(G = const、AG = 0)。 ΔG < 0、p、T = const。 以上のことから、生体エネルギー過程の研究においてギブズエネルギーが重要な役割を果たしていることがわかります。 この状態関数を使用すると、生物学的システムにおける自発的プロセスの方向を予測し、達成可能な最大効率を計算できます。 エンタルピーHと同様に、ギブズエネルギーGはシステムの状態の関数です。 したがって、ギブズエネルギーΔGの変化は、エンタルピーΔНの変化と同様の方法で化学変換を特徴付けるために使用できます。 これらの反応に対応するギブズエネルギーの変化が示される反応方程式は、熱化学とも呼ばれます。 システムのギブスエネルギーが減少し (ΔG < 0)、仕事が行われる化学反応は、発エルゴンと呼ばれます。 その結果、ギブスエネルギーが増加し (ΔG > 0)、システムで作業が行われる反応は、吸エルゴンと呼ばれます。 熱力学の第二法則から導き出されたギブズエネルギーは、状態の関数です。 したがって、エンタルピーと同様に、ギブズエネルギーのヘスの法則は次の形式で定式化できます。 一定の圧力および温度での所与の試薬からの所与の生成物の形成中のギブズエネルギーの変化は、これらの生成物の形成をもたらす反応の数およびタイプに依存しない。 ヘスの法則の適用の重要な例は、グルコース酸化と酸素分子の反応のギブズ エネルギーの計算です。 p = 101 kPa および T = 298°K でのこの反応におけるギブス エネルギーの変化は、体外で測定され、ΔG° = 2880 kJ/mol です。 対応する熱化学方程式は次のように記述されます。 С6Н12О6 + 6O2 = 6CO2 +6Н2ああ、ΔGpya° = 2880 kJ/モル。 体の細胞では、この反応は生化学者によって研究されたいくつかの連続した段階を経て実行されます。 ヘスの法則から、すべての中間反応におけるギブス エネルギー変化の合計は ΔG であると予測できます。pya: ΔG1 +ΔG2 +ΔG3 + … + ΔGn = ΔGpya °。 反応のギブス エネルギーは、生成物の化学量論量の形成のギブス エネルギーの代数和から化学量論量の反応物の形成のギブス エネルギーの代数和を引いた値に等しくなります。 ΔGpya =(ncΔGc +いいえDΔGD)(nAΔGA +いいえBΔGB). 9. ソリューション。 ソリューションの分類 凝集の状態によって、溶液は気体、液体、固体になります。 溶液は溶質と溶媒で構成されていますが、これらの概念はやや恣意的です。 たとえば、アルコールと水の量の比率に応じて、このシステムは、アルコールが水に溶解した溶液または水がアルコールに溶解した溶液になります。 通常、溶媒は、溶解前と同じ凝集状態で溶液中にある成分であると考えられます。 血液、リンパ、尿、唾液、汗などの最も重要な体液は、塩、タンパク質、炭水化物、脂質の水溶液であるため、溶液の研究は医師にとって特に興味深いものです。 体液は、栄養素(脂肪、アミノ酸、酸素)、薬物の臓器や組織への輸送、および代謝産物(尿素、ビリルビン、二酸化炭素など)の体からの排泄に関与しています。 血漿は、リンパ球、赤血球、血小板などの細胞の媒体です。 体の液体媒体では、酸性度の一定性、塩分および有機物質の濃度が維持されます。 この恒常性は濃度恒常性と呼ばれます。 ソリューションの分類 モル質量が 5000 g/mol 未満の物質の溶液は低分子量化合物 (LMC) の溶液と呼ばれ、モル質量が 5000 g/mol を超える物質の溶液は高分子量化合物の溶液と呼ばれます ( HMC)。 電解質の解離の有無に基づいて、NMS 溶液は電解質溶液と非電解質溶液の XNUMX つのクラスに分類されます。 電解質溶液 - イオンに解離する塩、酸、塩基、両性電解質の溶液。 例えばKNOソリューション3、HCl、KOH、Al(OH)3 、グリシン。 電解質溶液の導電率は、溶媒の導電率よりも高くなっています。 非電解質の溶液 - 実際には水中で解離しない物質の溶液。 例えば、ショ糖、ブドウ糖、尿素の溶液。 無電解液の電気伝導度は、溶媒の電気伝導度とほとんど変わりません。 コロイド溶液とは対照的に、NMS(電解質および非電解質)の溶液は真と呼ばれます。 真の溶液は、組成の均一性と、溶質と溶媒の間に界面がないことによって特徴付けられます。 溶存粒子(イオンと分子)のサイズが 10 未満9メートル ほとんどのIUDは、分子(高分子)が化学結合によって相互接続された多数の繰り返し基またはモノマー単位で構成されているポリマーです。 IUDソリューションは高分子電解質ソリューションと呼ばれます。 高分子電解質には、ポリ酸(ヘパリン、ポリアデニル酸、ポリアスパラギン酸など)、ポリ塩基(ポリリジン)、ポリ両性電解質(タンパク質、核酸)が含まれます。 HMS ソリューションの特性は、NMS ソリューションの特性とは大きく異なります。 したがって、それらについては別のセクションで説明します。 この章では、低分子量の電解質、両性電解質、および非電解質の溶液について説明します。 10. 溶媒としての水 私たちの地球上で最も一般的な溶媒は水です。 体重70kgの平均的な人の体には約40kgの水分が含まれています。 同時に、約25kgの水が細胞内の液体に落ち、15kgは血漿、細胞間液、脳脊髄液、眼内液、胃腸管の液体内容物を含む細胞外液です。 動物や植物の生物では、水分は通常50%以上であり、場合によっては水分含有量が90〜95%に達します。 その異常な特性により、水は生命に完全に適合した独特の溶媒です。 まず第一に、水はイオン化合物と多くの極性化合物をよく溶かします。 水のこの特性は、その高い誘電率 (78,5) に大きく関連しています。 水によく溶ける別の大きなクラスの物質には、糖、アルデヒド、ケトン、アルコールなどの極性有機化合物が含まれます。 それらの水への溶解度は、水分子がこれらの物質の極性官能基、たとえばアルコールや糖のヒドロキシル基、またはアルデヒドやケトンのカルボニル基の酸素原子と極性結合を形成する傾向によって説明されます。 以下は、生物系における物質の溶解度にとって重要な水素結合の例です。 水は極性が高いため、物質の加水分解を引き起こします。 水は体の内部環境の主要部分であるため、体内での栄養素の吸収、移動、および代謝産物のプロセスを提供します。 水は物質、特にグルコースの生物学的酸化の最終生成物であることに留意すべきである。 これらのプロセスの結果として水が生成されると、大量のエネルギー(約 29 kJ/mol)が放出されます。 水のその他の異常な特性も重要です。高い表面張力、低い粘度、高い融点と沸点、および固体状態よりも液体状態の方が高密度です。 水は、水素結合によって結合された分子のグループである会合体の存在によって特徴付けられます。 水に対する親和性に応じて、溶解した粒子の官能基は、親水性 (水を引き寄せる)、水によって容易に溶媒和される、疎水性 (水をはじく)、および両親媒性に分けられます。 親水基には極性官能基が含まれます: ヒドロキシル -OH、アミノ -NH2 、チオール-SH、カルボキシル-COOH。 疎水性 - 非極性基、例えば炭化水素ラジカルへ: CHXNUMX-(CH2)п -、 から6Н5 -。 親水性物質には、分子内に両方の親水基(-OH、-NH)を含む物質(アミノ酸、タンパク質)が含まれます。2 、-SH、-COOH) および疎水基: (CH3 -(CH2)п 、-から6Н5 - )。 両親媒性物質が溶解すると、疎水性基との相互作用の結果、水の構造が変化します。 疎水基に近い水分子の秩序化度が高まり、水分子と疎水基との接触が最小限に抑えられます。 疎水性基は、会合して、水分子をその場所の領域から押し出します。 11.溶液の濃度とその表現方法 ソリューション 平衡状態にあるXNUMXつ以上の物質の可変組成の均一なシステムと呼ばれます。 溶液を構成する物質を溶液成分と呼びます。 溶液の重要な特徴はその濃度です。 この値は、ソリューションの多くのプロパティを決定します。 物質濃度 (溶液成分)は、溶液または溶媒の特定の質量または体積に含まれる溶質の量によって測定される量です。 濃度を表す最も一般的な方法は、質量分率、モル濃度、モル当量濃度、モル分率、体積分率、力価です。 質量分率W(X) 単位の分数、パーセント (%)、ppm (パーセントの 1 分の XNUMX)、および XNUMX 万分の XNUMX (ppm) で表されます。 質量分率は次の式で計算されます。 W(X) = m(X)/m(年), W(X) = m(X)/m(年) × 100%、 ここでm(X) -指定されたコンポーネントの質量X(溶質)、kg(g); m(年)は溶液の質量、kg(g)です。 モル濃度は mol/m で表されます3 、mol/dm3 、mol/cm3 、mol/l、mol/ml。 医学では、モル/リットルの単位の使用が好ましいです。 モル濃度は次の式で計算されます。 C(X) =n(バツ)/V(pp) = m(X)/M(X) ×V(笑), ここでn(バツ) - システムの溶解物質の量、mol; M(X) は溶質のモル質量、kg/mol または g/mol です。 m(X) 溶解した物質の質量、それぞれkgまたはg。 V(笑) - 溶液の量、l。 モル濃度 b(X) mol/kg の単位で表されます。 記録形式、例:b(HCl)\ u0,1d XNUMX mol/kg。 次の式でモル濃度を計算します。 b(X) =n(バツ)/m(ル) = m(X)/M(X) ×m(ル) ここでm(ル) - 溶媒の質量、kg。 化学では、等価係数と等価係数の概念が広く使用されています。 同等 は、物質 X の実粒子または条件付き粒子と呼ばれます。これは、特定の酸塩基反応では XNUMX つの水素イオンに相当し、特定の酸化還元反応では XNUMX つの電子に相当し、塩間の特定の交換反応では電荷の単位に相当します。 。 体積分率f(バツ) 単位の分数またはパーセンテージで表される場合、次の式で計算されます。 Ф(バツ) = V(X)/ v(笑) ここで、v(X) -ソリューションのこのコンポーネントXのボリューム。 V(笑) は溶媒の総量です。 溶液の力価はTで表されます(バツ)、測定単位 - kg/cm3 、g/cm3 、g/ml。 溶液の力価は、次の式を使用して計算できます。 Т(バツ) = m(X)/ v(笑) ここでm(X) は物質の質量で、通常は g です。 V(笑) 溶液量、ml。 12.溶解プロセス 溶解プロセスの性質は複雑です。 当然のことながら、なぜ一部の物質は一部の溶媒に溶けやすく、他の溶媒には難溶性または実質的に不溶性であるのかという疑問が生じます。 ソリューションの形成は、常に特定の物理的プロセスに関連しています。 そのようなプロセスのXNUMXつは、溶質と溶媒の拡散です。 拡散により、粒子(分子、イオン)が溶解した物質の表面から除去され、溶媒の全体積全体に均一に分布します。 そのため、攪拌がない場合、溶解速度は拡散速度に依存します。 しかし、物理的プロセスだけでは、さまざまな溶媒への物質の不均一な溶解度を説明することは不可能です。 ロシアの偉大な化学者 D. I. メンデレーエフ (1834-1907) は、化学プロセスが溶解に重要な役割を果たすと信じていました。 彼は硫酸水和物の存在を証明した H2SO4H2ああ2SO42H2ああ2SO44H2Oおよびその他の物質、たとえばC2Н5OH3H2A. このような場合、溶解には溶質の粒子と溶媒の間の化学結合の形成が伴います。 このプロセスは溶媒和と呼ばれ、特に溶媒が水である場合、水和と呼ばれます。 確立されているように、溶解した物質の性質に応じて、物理的相互作用、つまりイオン双極子相互作用(たとえば、イオン構造を持つ物質(NaCl など)の溶解中)の結果として溶媒和物(水和物)が形成されることがあります。 ); 双極子間相互作用 - 分子構造を持つ物質の溶解中(有機物質))。 化学的相互作用は、ドナー-アクセプター結合により行われます。 ここで、溶質イオンは電子受容体であり、溶媒 (Н2ああ、NH3) - 電子供与体(例えば、アクア錯体の形成)、および水素結合の形成の結果(例えば、水へのアルコールの溶解)。 溶質と溶媒の化学的相互作用の証拠は、熱効果と溶解に伴う色の変化によって提供されます。 たとえば、水酸化カリウムが水に溶解すると、熱が放出されます。 KOH + xN2O \uXNUMXd KOH(N2おー; ΔH°解決 = 55 kJ/モル。 そして、塩化ナトリウムが溶解すると、熱が吸収されます。 NaCI + xH2O = NaCl(H2おー; ΔH°解決 = +3,8 kJ/モル。 1モルの物質が溶解したときに放出または吸収される熱は、 溶解熱 Q解決 熱力学の第一法則によると Q解決 = ΔH解決, ここで、ΔH解決 一定量の物質が溶解したときのエンタルピーの変化です。 無水白色硫酸銅を水に溶解すると、濃い青色になります。 溶媒和物の形成、色の変化、熱効果、および他の多くの要因は、その形成中の溶液の成分の化学的性質の変化を示しています。 したがって、現代の概念によれば、溶解は、物理的および化学的タイプの相互作用の両方が役割を果たす物理化学的プロセスです。 13. 溶解過程の熱力学 熱力学の第 XNUMX 法則によると、p、T = const で、このプロセスの結果として系のギブス エネルギーが減少する場合、物質は任意の溶媒に自然に溶解できます。 ΔG = (ΔН - TΔS) < 0. ΔН の値はエンタルピー係数と呼ばれ、TΔS の値は溶解のエントロピー係数と呼ばれます。 液体と固体の物質が溶解すると、溶解した物質は規則性の高い状態から規則性の低い状態に移行するため、系のエントロピーは通常増加します (ΔS > 0)。 溶解度の増加に寄与するエントロピー係数の寄与は、高温で特に顕著です。この場合、係数 T が大きく、積 TΔS の絶対値もそれぞれ大きいため、Gibbs の減少エネルギーが増加します。 気体が液体に溶解すると、溶質が秩序のない状態(体積が大きい)から秩序のある状態(体積が小さい)に移行するため、システムのエントロピーは通常減少します(ΔS<0)。 この場合、係数Tが小さく、積TΔSの絶対値が小さくなり、ギブズエネルギーの減少が大きくなるため、温度の低下はガスの溶解に有利に働きます。Tの値は低くなります。 溶液の形成中に、システムのエンタルピーも増加 (NaCl) と減少 (KOH) の両方になる可能性があります。 溶解プロセスのエンタルピーの変化は、溶解プロセスに伴うすべてのプロセスの吸熱および発熱の寄与の代数和として、ヘスの法則に従って考慮する必要があります。 これらは、物質の結晶格子の破壊の吸熱効果、分子の結合の切断、溶媒の初期構造の破壊、および溶媒和物を含むさまざまな相互作用生成物の形成の発熱効果です。 表示を簡単にするために、溶解エンタルピーの増分ΔН解決 エネルギー差Eとして表すことができますcr、溶解した物質の結晶格子の破壊に費やされた、そしてエネルギーEゾル、溶媒分子による溶質粒子の溶媒和中に放出されます。 つまり、エンタルピー変化は、エンタルピー変化 ΔH の代数和です。cr 結晶格子の破壊とエンタルピーΔНの変化の結果としてゾル 溶媒粒子による溶媒和による: ΔN解決 = ΔHcr +ΔНゾル, ここで、ΔH解決 - 溶解中のエンタルピー変化。 ただし、有機溶媒への希ガスの溶解は、多くの場合、熱の吸収を伴います。たとえば、アセトン、ベンゼン、エタノール、およびシクロヘキサン中のヘリウムとネオンです。 分子結晶構造を持つ固体と液体を溶解する場合、分子結合はあまり強くないため、通常 ΔHゾル > ΔNcr これは、例えば、アルコールや糖の溶解が発熱過程であるという事実につながります(ΔН解決 <0)。 イオン格子を持つ固体を溶解する場合、エネルギー比 Ecr とEゾル 異なる場合があります。 ただし、ほとんどの場合、イオンの溶媒和中に放出されるエネルギーは、結晶格子の破壊に費やされたエネルギーを補償しないため、溶解プロセスは吸熱的です。 このように、熱力学データは、熱力学の第 XNUMX 法則と第 XNUMX 法則に基づいて、さまざまな物質の自然溶解を予測することを可能にします。 14. 溶解度 溶質が溶媒と接触している場合、多くの場合、溶液形成のプロセスは、特定の限界濃度に達するまで(飽和が発生するまで)自発的に進行します。 これは、平衡に達したとき、エンタルピー係数とエントロピー係数が等しいとき、つまりΔН=TΔSのときに発生します。 たとえば、結晶が液体に導入されると、分子またはイオンが結晶の表面から溶液に移動します。 拡散により、粒子は溶媒全体に均一に分布します。 溶解は飽和に至る。 所定の温度で最大量の溶質を含み、過剰な溶質と平衡状態にある溶液は、飽和溶液と呼ばれます。 過飽和溶液とは、飽和溶液よりも濃度が高い溶液のことです。 飽和溶液よりも低濃度の溶液は不飽和と呼ばれます。 物質が特定の溶媒に溶解する能力は、溶解度と呼ばれます。 数値的には、物質の溶解度はその飽和溶液の濃度に等しくなります。 溶解度は、濃度と同じ単位で表すことができます。たとえば、1 リットルの飽和溶液に含まれる溶質の量、mol/l、または 100 g の飽和溶液中の溶質の質量で表すことができます。 . 溶解度の単位は、溶媒 100 g あたりのグラム数です。 対応する値は、溶解度係数と呼ばれます。 溶解度は、溶質と溶媒の性質、温度、圧力、および溶液中の他の物質の存在に依存します。 成分の性質の溶解度への影響 溶解する物質の能力は、溶液Xの成分の分子間の相互作用の力の性質によって決定されます1 彼ら2 : 溶媒 - 溶媒 (X1 - NS1 )、溶質 - 溶質 (X2 - バツ2 )、溶媒 - 溶質 (X1 - バツ2 ) (ドットは分子結合を示す)。 物質の溶解度は大きく異なります。 例は、同じ溶媒(水)への異なる塩の溶解度と同じ物質(AgNO3 ) さまざまな溶媒で。 イオン型の結合を持つ物質や極性分子からなる物質は、水やアルコールなどの極性溶媒によく溶けます。 これらの溶媒は、誘電率が高いという特徴があります。 物質の高い溶解度は、多くの場合、分子間結合、特に水素結合の形成によるものです。 したがって、水とアルコールの無制限の相互溶解性は、水とアルコール分子間の水素結合の形成によって説明され、アンモニア水溶液中の AgcI 結晶の溶解は、銀の化学的なドナー - アクセプター結合の形成によって説明されます。アンモニア分子とイオンを結合します (AgCl は水にほとんど溶けません)。 同じ理由で、誘電率の低い溶媒であるピリジンは非常に高い溶解度を示します。 溶解度は真の平衡を特徴付けるため、この状態に対する外部条件 (圧力、温度) の影響は、ル シャトリエの原理を使用して定性的に推定できます。 このような評価は、ディープ ダイビングの練習やホット ショップでの作業などに必要です。 15.液体中の気体の溶解度。 ヘンリー・ダルトンとセチェノフの法則 液体中の気体の溶解は、ほとんどの場合、熱の放出を伴います。 したがって、ルシャトリエの原理によれば、ガスの溶解度は温度の上昇とともに低下します。 このパターンは、沸騰によって水から溶存ガス(CO02など)を除去するためによく使用されます。 ガスの溶解には、熱の吸収が伴う場合があります(たとえば、一部の有機溶媒への希ガスの溶解)。 この場合、温度を上げるとガスの溶解度が上がります。 気体は液体に無限に溶解しません。 特定のガス濃度 X で、平衡が確立されます。  気体が液体に溶解すると、システムの体積が大幅に減少します。 したがって、ルシャトリエの原理によると、圧力の増加は、平衡の右へのシフト、つまりガスの溶解度の増加につながるはずです。 ガスが特定の液体にわずかに溶解し、圧力が低い場合、ガスの溶解度はその圧力に比例します。 この依存関係は、ヘンリーの法則(1803)によって表されます。 平衡状態で所定の体積の液体に所定の温度で溶解する気体の量は、気体の圧力に正比例します。 ヘンリーの法則は次の形式で書くことができます。 с (バツ) =K処方箋) ×P(X) ここで、は飽和溶液中のガスの濃度、mol/lです。 P(X) - 溶液上のガス圧 X、Pa; K処方箋) -ガスXのヘンリー定数、mol×l1×Pa1 . ヘンリー定数は、ガス、溶媒、および温度の性質によって異なります。 ヘンリーの法則は、低圧で、溶存ガスの分子と溶媒との間に化学的相互作用がない場合に、比較的希薄な溶液に対してのみ有効です。 ヘンリーの法則は、一般的なダルトンの法則の特殊なケースです。 XNUMXつのガス状物質ではなくガスの混合物の溶解について話している場合、各成分の溶解度はダルトンの法則に従います。 一定温度でのガス混合物の各成分の溶解度は、液体上の成分の分圧に比例し、混合物の全圧や他の成分の個性には依存しません。 言い換えれば、気体の混合物を液体に溶解する場合、分圧p! このコンポーネント。 コンポーネントの分圧は、ガス混合物の全圧に対するコンポーネントの圧力の比率として理解されます。 Рi/ R一般的な コンポーネントの分圧は、次の式で計算されます。 ロシアの生理学者 I. M. セチェノフ (1829-1905) は、電解質の存在下で液体中の気体の溶解度を研究し、次のパターン (セチェノフの法則) を確立しました。 ガスが放出されます。 Рi = P一般的な ×(Xi) ここで pi -コンポーネントXの分圧i; Р一般的な ガス混合物の全圧; x(Xi) は、i 番目のコンポーネントのモル分率です。 ロシアの生理学者 I. M. セチェノフ (1829-1905) は、電解質の存在下での液体への気体の溶解度を研究し、次のパターン (セチェノフの法則) を確立しました。 ガスが放出されます。 16.生物系における物質の移動過程における拡散の役割 拡散は生物系において重要な役割を果たしています。 まず第一に、組織液中の栄養素と代謝産物の移動は拡散によって起こります。 さらに、多くの場合、生体内の物理化学的プロセスの速度は、反応物の拡散速度によって決定されます。これは、反応物の拡散がプロセスの最も遅い段階であるのに対し、酵素が関与する生化学反応は非常に迅速に進行するためです。 すべての生きている細胞は、細胞内環境を保護および調節する役割を果たす膜に囲まれています。 物質は、通常の拡散 (受動輸送) とエネルギー的に活性化された移動 (能動輸送) という XNUMX つの主なメカニズムによって膜を通過します。 膜の内層は炭化水素鎖で構成されています。 したがって、多くの小さな中性分子と非極性 HMS 分子はこの層に可溶であり、濃度勾配に沿った通常の拡散によって膜を通過できます。 このような物質の輸送は受動的と呼ばれます。 拡散は、肺内の血液に酸素を供給するプロセスにおいて大きな役割を果たします。 分岐が大きいため、肺の肺胞の表面積は大きく(約 80 m2)、そのため酸素は積極的に血漿に溶解し、赤血球に入ります。 静脈血は酸素が枯渇しており、静脈血中の酸素濃度はゼロになる傾向があります。 その結果、大気と肺に入る血液との間の酸素濃度勾配が高くなり、(フィックの法則による)活発な吸収が起こります。 勾配に逆らって、濃度の低い領域から濃度の高い領域へ物質を移動させることを能動輸送といいます。 このようなプロセスは自然発生的に起こることはなく、エネルギーの消費が必要です。 エネルギー源は、生体無機化合物であるアデノシン三リン酸 (ATP) の加水分解による発エルゴン反応です。 セル内外のKイオン濃度の安定した定常分布は、膜を通ってセルに入るKイオンの流れが、受動拡散によりセルからのKイオンの流れと等しくなるときに達成されます。 分布(イオンホメオスタシス)はNaイオンでも同様に達成され、イオンの能動輸送と補償受動拡散のみが、対応するKイオンの流れと反対に向けられます。 拡散プロセスは医療で広く使用されています。 例えば、濃度勾配に沿った半透膜を通る低分子物質の拡散の選択性に基づく透析方法は、臨床現場で「人工腎臓」デバイスを作成するために使用されています。 IUD 粒子は半透膜を通過しないため、体液 (血漿など) は透析によって有害な低分子物質 (尿素、尿酸、ビリルビン、アミン、過剰な K イオン) から精製できます。 )さまざまな病気で蓄積します。 精製中、静脈から排出された患者の血液は、半透膜を備えた特別なチャンバーに入り、NMS が拡散して血漿から除去されます。 多くの炎症性疾患では、タンパク質の破壊が起こり、血漿では、NMSとともに、タンパク質の断片(ペプチドおよびポリペプチド)も除去する必要があります。 17.溶液の凝固点を下げ、沸点を上げる 溶液上の蒸気圧の低下の直接的な結果は、凝固点ΔТの変化です。з および溶液の沸点 ΔTк 純粋な溶媒のこれらの量の値と比較してください。 これらの量の間の関係も、熱力学の第 XNUMX 法則に従います。 液体の沸点は、その蒸気圧が外圧と等しくなる温度です(たとえば、101,3 kPaでは、水の沸点は100°Cです)。 液体の凝固点(結晶化)は、液体の蒸気圧が固相の蒸気圧と等しくなる温度です。 溶液の凝固点と沸点をT3とTkに指定し、溶媒T°に同じ値を指定すると3 およびT°к 、次に取得します。 ΔTk = Tк -T°к > 0、 ΔT3 = T°3 -T3 > 0。 溶液の沸点上昇と凝固点低下の効果は、ル シャトリエの原理を使用して定性的に説明できます。 確かに、平衡系「液体 - 蒸気」(たとえば、H2О(H) -H2О(G))、可溶性の不揮発性物質を導入すると、溶液上の溶媒の蒸気圧が低下します。 蒸気圧の低下を補って前の平衡状態を達成するには、プロセスが吸熱であるため、溶液をより高い温度 (373°K 以上) に加熱する必要があります。 平衡系「固相 - 液体」があるとします。たとえば、H2О(T) >H2О(H)、273°Kで。 一定量の不揮発性物質(固相に不溶)が液相に溶解すると、液相中の水分子の濃度が減少します。 ル・シャトリエの原理に従って、液相中の水の量を増加させるプロセス、つまり氷の融解が始まります。 新しい平衡を確立するには、プロセスが発熱するため、溶液を冷却する必要があります。つまり、温度を下げる必要があります。 希薄溶液のラウルの法則によれば、蒸気圧の低下は溶液の濃度に比例します。 したがって、そのような溶液の沸点の上昇と凝固点の低下は、それらの濃度の増加とともに増加するはずです。 溶液の凍結と沸騰を研究して、ラウルは次のことを発見しました: 沸点の上昇 ΔTк 凝固点ΔTを下げる3 非電解質の希釈溶液は、溶液のモル濃度に正比例します。 ΔTк = Kэb(x)は, ΔT3 = Kз b(x)は, ここでb(X) -モル濃度、mol / kg; Кз そしてKэ -比例係数、 kg × K × mol1 、それぞれ ebulliometric 定数と cryometric 定数と呼ばれます。 定数 K の物理的意味э そしてKз bを受け入れると明らかになる(X) = 1. 次に Kэ =ΔTк 、およびKз =ΔTз 。 言い換えれば、沸騰測定定数は数値的には XNUMX モル溶液の沸点の上昇に等しく、低温測定定数は XNUMX モル溶液の凝固温度の低下に等しいということです。 エブリオメトリック定数とクライオメトリック定数は、溶媒の性質のみに依存し、溶質 (理想的な溶液) の性質には依存しません。 18.浸透圧 浸透は、溶媒から溶液へ、または低濃度の溶液から高濃度の溶液への半透膜を介した溶媒分子の主に片側浸透(拡散)です。 浸透が発生するために必要な条件は、半透膜によって分離された、溶媒と溶液または異なる濃度のXNUMXつの溶液の存在です。 熱力学の観点から見ると、浸透の原動力は、濃度を均一にしたいというシステムの欲求です。この場合、システムがより秩序のない状態に移行するため、システムのエントロピーが増加し、システムのギブズエネルギーが増加するためです。それに応じて減少し、化学ポテンシャルは等化されます。 したがって、浸透は自発的なプロセスです。 簡単な実験は、浸透のメカニズムと溶液中の蒸気圧の変化との関係を説明する例として役立ちます。 純粋な溶媒を含むガラスといくつかの非揮発性物質の溶液を含むガラス(容器内の液体のレベルが同じ)を密閉されたガラス容器に入れると、しばらくすると、最初のガラスが減少し、XNUMX番目のガラスの溶液のレベルが増加します。 この場合、溶媒は最初のビーカーからXNUMX番目のビーカーに移動します。これは、(ラウールの法則に従って)純粋な溶媒よりも溶液上の溶媒の蒸気圧が低いためです。 したがって、溶媒と溶液の間の空間は半透膜として機能します。 壁が半透性の容器にブドウ糖の水溶液を入れ、水を入れた別の容器に入れて、これらの容器内の液体のレベルが一致するようにします。 浸透の結果、最初の容器内の溶液の体積が増加し、この容器内の液面が徐々に上昇します。 これにより、浸透を防ぐ追加の静水圧が作成されます。 浸透平衡での液柱の静水圧は、溶液の浸透圧を決定します。 浸透圧 浸透を止めるために溶液に加えなければならない最小水圧によって測定された値と呼ばれます。 浸透圧の法則。 Van't Hoff は、非電解質の希薄溶液の浸透圧を計算するための経験式を提案しました。 π = C(バツ)RT、 どこで π - 浸透圧、kPa; С(バツ) -モル濃度、mol / l; R は、に等しい普遍的なガス定数です。 8,31 kPa - l / (モル - K); T は絶対温度、K です。 ファントホッフの法則は実験データに基づいて確立されましたが、ΔG= 0での熱力学的平衡の条件から導き出すことができます。したがって、この法則は熱力学の第XNUMX法則の結果として考慮する必要があります。 上記の形式の式は、理想気体のクラペイロン-メンデレーエフ方程式に似ていますが、これらの方程式は異なるプロセスを表しています。 19.生物系における浸透と浸透圧の役割 浸透の現象は、多くの化学的および生物学的システムで重要な役割を果たしています。 浸透は、細胞および細胞間構造への水の流れを調節します。 組織の弾力性と特定の形状の臓器の保存を保証する細胞の弾力性(膨圧)は、浸透圧によるものです。 動物や植物の細胞は、半透膜の特性を持つ原形質の殻または表面層を持っています。 これらの細胞を異なる濃度の溶液に入れると、浸透が観察されます。 同じ浸透圧を有する溶液を等張性といいます。 XNUMX つの溶液の浸透圧が異なる場合、浸透圧の高い溶液は XNUMX 番目の溶液に対して高張であり、XNUMX 番目の溶液は最初の溶液に対して低張です。 細胞を等張溶液に入れると、細胞はそのサイズを維持し、正常に機能します。 細胞を低張溶液に入れると、濃縮度の低い外部溶液からの水が細胞に入り、細胞が膨張し、膜が破裂して細胞内容物が流出します。 この細胞の破壊は溶解と呼ばれ、赤血球の場合、このプロセスは溶血と呼ばれます。 溶血の際に細胞内容物が出てきた血液は、その色からニス血と呼ばれます。 細胞を高張溶液に入れると、水が細胞からより濃縮された溶液になり、細胞のしわ(乾燥)が観察されます。 この現象は原形質溶解と呼ばれます。 人間の体液 (血液、リンパ液、組織液) は、低分子量化合物 - NaCl、KCl、CaCl、高分子量化合物 - タンパク質、多糖類、核酸、および有形成要素 - 赤血球、白血球、血小板の水溶液です。 それらの総合的な効果が体液の浸透圧を決定します。 310°K (37°C) での人間の血液の浸透圧は 780 kPa (7,7 atm) です。 同じ圧力が 0,9% NaCl 水溶液 (0,15 mol/l) によって生成されるため、血液 (生理食塩水) と等張です。 ただし、Na イオンと C1 イオンに加えて、血液中には他のイオン、IUD および形成された元素があります。 したがって、医療目的では、血液を構成する成分と同じ成分を同じ量で含む溶液を使用する方が正しい. これらの溶液は、手術で代用血液として使用されます。 人体は、浸透圧に加えて、恒常性(恒常性)および酸性度などの血液の他の物理化学的指標によって特徴付けられます。 血液の浸透圧の許容変動は非常に小さく、重度の病状でも数十kPaを超えません。 さまざまな手順で、人間や動物の血液に大量に注入できるのは等張液だけです。 大量の失血がある場合(たとえば、大手術や怪我の後)、患者は数リットルの等張液を注射され、血液で体液の損失を補います。 浸透現象は、医療行為で広く使用されています。 そのため、手術では、化膿性創傷に注入される高張ドレッシング(高張10%NaCl溶液に浸したガーゼ)が使用されます。 浸透の法則によれば、ガーゼを通る創傷液の流れは外側に向けられ、その結果、創傷から膿、微生物、腐敗生成物が絶えず浄化されます。 20.解離度(イオン化)。 電解質の強さ ほぼ完全にイオンに解離(イオン化)した電解質を強電解質、完全にイオン化していない電解質を弱電解質と呼びます。 弱い電解質の溶液には、イオンとともに、イオン化されていない分子があります。 S.アレニウスが弱い電解質の溶液の等張係数が整数に等しくない理由を説明したのは、不完全なイオン化によるものでした。 解離の完全性を定量的に特徴付けるために、解離度 (イオン化) の概念が導入されます。 電解質の解離(イオン化)の程度は、溶液に導入された分子の総数に対する、イオンに分解された分子の数の比率です。 つまり、an はイオンに分解された電解質分子の割合です。 解離の程度は、単位のパーセンテージまたは分数として表されます。 αн = Nн/ Np, ここで、N はイオンに分解された電解質分子の数です。 Np 溶液に導入された(溶解した)電解質分子の数。 したがって、Cの場合(CHXNUMXCOOH) = 0,1 mol/l、解離度αн = 0,013 (または 1,3%)。 解離の程度に応じて、電解質は従来、強い(αн > 30%) および弱い (αн < 3%)。 この区間では、電解質は中程度の強度であると見なされます。 ほとんどすべての塩は強電解質と見なされます。 最も重要な酸と塩基のうち、H2SO4 、HCI、HBr、HI、HNO3 、NaOH、KOH、Ba(OH)2 。 ほとんどの有機酸と一部の無機化合物は弱電解質 - H に属します。2S、HCN、N2WITH3 、 それで3 、HClO、N2オン3IN3 、Hg2CI2 、Fe(SCN)3 。 Anは、理想的な溶液の理論的依存性からの電解質溶液の照合特性の偏差を測定することによって実験的に決定されます。 たとえば、等張係数iは凝固点降下法で決定され、解離度が計算されます。強電解質の場合、イオンにほぼ完全に解離するため、解離度は明らかです。 整数の知識からの等張係数iの偏差は、溶液中の関連のない分子の存在によってではなく、他の理由によって説明されます。 解離は、熱の放出または吸収を伴います。 したがって、解離の程度は温度に依存する必要があります。 温度の影響は、ルシャトリエの原理に従って推定することができます。 電解解離が熱の吸収とともに進行する場合、温度の上昇とともに増加し、熱の放出とともに進行する場合、減少します。 電解解離の程度は、溶液の濃度に影響されます。 溶液が希釈されると、解離の程度が大幅に増加します。 これに関して、解離度αによる電解質の強度の示された分類н 約 0,1 mol/l の濃度の溶液に対してのみ有効です。 電解解離を平衡可逆プロセスと見なすと、ルシャトリエの原理に従って、水で希釈すると蒸留分子の数が増加します。つまり、解離の程度が増加します。 弱電解質の解離の程度は、同名のイオンの添加によっても影響を受けます。 したがって、平衡系に弱い電解質を導入すると、イオンの濃度が増加し、ルシャトリエの原理に従って、解離平衡が左に大きくシフトします。つまり、解離度が減少します。 . したがって、同じ名前のイオンを弱電解質溶液に添加すると、その解離の程度が低下します。 21. 解離定数。 オストワルドの繁殖法則。 強電解質の溶液理論 定量的には、平衡可逆プロセスとしての電解解離は、質量作用の法則によって決定される解離 (イオン化) 定数によって特徴付けることができます。 質量作用の法則は、厳密に言えば、可逆反応、つまり弱い電解質の溶液に適用されます。 たとえば、KtnAnm電解質の解離は、平衡プロセスとして表すことができます。 Ktn Anm ×nKtm+ +ミリアンペアn . 質量作用の法則によると、平衡定数は次のように記述されます。 КД =(Ktm+)n+(アンn)m + (KtnAnm) ここで (Ktm+) とn ) - 電解質イオンのモル平衡濃度; (KtnAnm) は解離していない電解質分子のモル平衡濃度です。 КД は、解離定数と呼ばれる平衡定数です。 この方程式は、弱電解質の希薄溶液に対してのみ有効です。 濃縮溶液や強電解質の溶液に適用する場合は、方程式を修正する必要があります。 解離定数Kが大きいほどД 、電解質がより多く解離します。 解離度Kとは対照的にД 溶媒、電解質、温度の性質のみに依存し、溶液の濃度には依存しません。 したがって、電解解離の定数と程度は両方とも解離の定量的特性です。 当然、それらの間にはつながりがあります。 多塩基酸と多酸塩基は段階的に解離します。 たとえば、リン酸の解離は XNUMX つのステップで発生します。  同様に、ポリ酸塩基 (たとえば、Ca (OH)2) - 解離は XNUMX 段階で発生します。 段階的解離は、後続の各段階での電解質の分解が、前の段階よりも少ない程度で起こるという事実によって特徴付けられます。 このような解離定数の変化は、クーロンの法則に基づく静電引力によって説明できます。 イオン化エネルギーは、イオンが中性電解質分子から離れたときに最小になります。 解離の各次のステップでのイオンの脱離には、エネルギーの増加が必要です。これは、イオンの除去は、後続のステップで電荷が大きくなる粒子から発生するためです。 溶液の濃度に関係なく、強電解質がほぼ完全にイオンに解離することは、物理的および物理化学的研究方法によって確認されています。 したがって、希溶液中の強塩基によるすべての強酸の中和熱の値はほぼ同じです。 酸と塩基の性質に関係なく、同じ値 AH = 56,5 kJ/mol が得られます。 この事実は、酸と塩基の希薄溶液が完全に解離していることの明らかな証拠です。 すべての場合において、中和中に起こる共通のプロセスは、モル内のイオンの結合です。 22. 酸と塩基の理論 多くの電解質、特にさまざまな元素 E の水酸化物は、酸または塩基の特性を示します。 EON 水酸化物の解離は、次の XNUMX つのタイプで進行します。 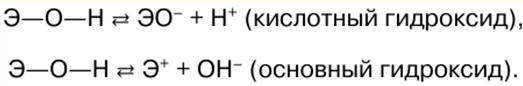 ギャップは、グループの両方の結合に沿って発生する可能性があります E-O-N。 知られているように、結合の極性と強度は、元素の電気陰性度の違い、原子のサイズと有効電荷に依存します。 O-H結合の切断エネルギーがE-O結合の切断エネルギーよりもはるかに小さい場合、水酸化物の解離は酸の種類に応じて進行します。 逆に、O-H結合を切断するエネルギーがE-O結合を切断するエネルギーよりもはるかに大きい場合、解離は主なタイプに従って進行します。 アルカリおよびアルカリ土類金属の水酸化物、ならびに低酸化状態の遷移金属では、E-O 結合の強度は比較的低く、酸素は水素とより強く結合し、E-O-H 解離は主に基本的なタイプに従って進行します。水酸化ジオンの除去を伴う。 これは、そのような元素のイオンのサイズがかなり大きく、有効電荷が小さいためです。つまり、分極能力が弱いためです。 酸化度が増加すると、E原子の分極効果が増加し(比電荷が増加し)、酸素が元素Eにより強固に結合し、E-O-Hの解離が主に酸の種類、つまり水素イオンに応じて発生します。分割されます。 後者は、酸素原子における電子密度の再分布に関連しています。 その結果、E-O結合はより強くなり、O-H結合はより弱くなります。 現在、酸と塩基の概念の明確な定義はありません。これは、任意の溶媒での酸-塩基相互作用を特徴づけるために等しく使用できます。 水溶液中の多くの電解質を特徴づけるために、アレニウスによって与えられた酸と塩基の概念を使用することはまだ可能です: 1)酸は、溶液中で解離して水素イオンHを形成する電解質です。 2) 塩基は、溶液中で解離して OH 水酸化物イオンを形成する電解質です。 3) 両性電解質 (両性水酸化物) は、溶液中で解離して水素イオンと水酸化物イオンの両方を形成する電解質です。 両性電解質には、亜鉛、アルミニウム、クロム、その他の両性元素の水酸化物、およびアミノ酸、タンパク質、核酸が含まれます。 Le Chatelier の原理を酸塩基平衡の連鎖に適用すると、系内のヒドロキシジオン OH の濃度が増加すると、酸型の解離の確率が増加することがわかります。 系内の水素イオン H+ の濃度が増加すると、主な種類に応じた優先的な解離が起こります。 これは、両性電解質は酸性環境では塩基性の性質を示し、アルカリ性環境では酸性の性質を示すことを意味します。 たとえば、水酸化亜鉛は酸と相互作用すると塩基のように振る舞います。 Zn(OH)2 + 2HCl - 亜鉛CI2 +2Н2ああ そしてアルカリと相互作用するとき - 酸として: Zn(OH)2+2NaOH→Na2[Zn(OH)4]. 23.血液緩衝システム。血漿。 緩衝系は、生物の酸塩基バランスを維持する上で非常に重要です。 すべての生物の細胞内および細胞外液は、緩衝系の助けを借りて維持される一定のpH値によって特徴付けられます。 ほとんどの細胞内液の pH 値は 6,8 から 7,8 の範囲です。 人間の血液中のCOバランスの酸塩基バランスは、炭酸水素塩、リン酸塩、およびタンパク質緩衝システムによって提供されます。 血漿の通常のpH値は7,40±0です。これは、05〜3,7x4,0 mol/lの活性酸性度値の範囲に対応します。 血液にはさまざまな電解質があるので(HC1083 、H2CO3 、H2RO4 、NRO42 )、タンパク質、アミノ酸、つまり、(H +)の活性が指定された範囲内になる程度に解離することを意味します。 血漿と血球の無機物質と有機物質の含有量は同じではないため、これらの血液成分を別々に検討することをお勧めします。 血漿 HCOバッファーシステム3 / N2WITH3 炭酸でできている2WITH3 および共役塩基HCO3 。 これは血液の最も重要な緩衝系です。 成分の一つは炭酸Hです2WITH3 - プラズマに溶解した CO の相互作用によって形成される2 水で: WITH2(r) + N2彼N2WITH3. ここで、CO2(r) - 溶存CO濃度2 . この反応の平衡定数は次のとおりです。 K = [N2WITH3] / [CO2] CO間2 肺の毛細血管を流れる血漿中の肺胞および炭酸水素塩緩衝液では、平衡の連鎖が確立されます。 炭酸水素塩緩衝液システムは、pH7,4付近で効果的な生理学的緩衝液として機能します。 酸の血に入ると-Hのドナー+ ルシャトリエの原理による鎖の平衡は、HCOイオンが3 HイオンをH分子に結合する2WITH3 . 同時に、Hの濃度2WITH3 増加し、HCO イオンの濃度3 低下する。 H濃度の増加2WITH3 平衡の左へのシフトにつながります(ルシャトリエの原理)。 それは腐敗を引き起こします2WITH3 CO濃度の上昇2 プラズマに溶解。 その結果、平衡は左にシフトし、CO の圧力が増加します。2 肺で。 過剰なCO2 体から排泄されます。 その結果、血液の炭酸水素塩システムはすぐにCOと平衡状態になります2 肺胞内に存在し、血漿の pH の一定性を効果的に維持します。 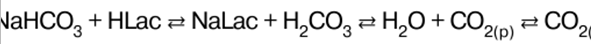 したがって、正常な血液の pH 値が維持され、アシドーシスによるわずかに顕著な pH シフトが生じます。 密閉された空間では、窒息(酸素不足)や呼吸の増加を経験することがよくあります。 ただし、窒息は酸素の不足ではなく、CO2の過剰に関連しています。 過剰なCO2 ヘンリーの法則によれば、大気中では、COの追加の溶解につながります2 血で。 そして、これは血液のpHの低下、すなわちアシドーシスにつながります。 炭酸水素緩衝システムは、血液の pH の変化に最も迅速に反応します。 その酸緩衝容量は Vк \ u40d XNUMX mmol / lの血漿、およびアルカリの緩衝能力ははるかに少なく、Vにほぼ等しいщ = 血漿 1-2 mmol/l。 24. 中和反応 中和反応は、酸と塩基の相互作用の交換反応と呼ばれ、その結果、塩と水が形成されます。 さまざまな種類の中和反応を検討してください。 1. 強酸による強塩基の中和: KOH + HNO3 -ノ3 + N2O. このような反応の分子イオン方程式 H+ +ああ →N2O およびギブスエネルギーΔG°の負の値は、平衡が実質的に水の形成に向かってシフトしていることを示しています。 中和反応の一般的なケースは、強度(解離の程度)が異なる酸と塩基の相互作用です。 これらの反応は、塩の加水分解の逆反応のために完了しません。 2.強塩基による弱酸の中和:  または分子の形で:  この場合、中和反応は可逆的です。 強酸による弱塩基の中和反応も可逆的です。  または分子の形で: 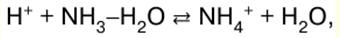 そしてまた-弱酸と弱塩基: 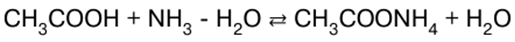 または分子の形で:  これらのシステムでは、水はシアン化水素酸、アンモニア、酢酸よりもはるかに弱い電解質であるため、平衡は右に大きくシフトします。 中和反応は中和法の基礎を形成します。 この方法は、胃液の酸性度、血漿の緩衝能力を決定するために臨床検査室で使用されます。 薬理学では、無機酸(塩酸、硫酸、ホウ酸)および有機酸(酢酸、安息香酸、酒石酸、クエン酸、サリチル酸)の定量分析に使用されます。 バイオ医薬品研究では、酸のpKaと塩基のpKaは中和によって決定されます。これは、これらの値の値が、薬物が生体膜を通過する能力を予測できるためです。 酸塩基滴定はpKを決定するために使用されますа アミノ酸とpKа タンパク質の解離基。 XNUMX つの異なる温度で得られたタンパク質滴定曲線を使用して、カルボキシル基、イミダゾール基、およびその他の基の数を決定できます。 アミノ酸とタンパク質の滴定により、それらの等電点を決定することができます。 加水分解は、水による物質の分解です。 タンパク質、脂肪、炭水化物、エステル、塩など、さまざまなクラスの化学化合物が加水分解を受ける可能性があります。無機化学では、塩の加水分解に最もよく遭遇します。 25.塩の加水分解 塩の加水分解 -これは塩と水分子の相互作用であり、低解離化合物の形成につながります。 加水分解のプロセスは、水分子から特定のイオン (CO32 + HOH * HCO3+ああ )または水和金属カチオンを含む特定のイオンから水分子へ。 塩の性質に応じて、水は酸または塩基のいずれかとして機能し、塩はそれぞれ共役塩基または共役酸です。 塩の種類に応じて、XNUMX 種類の加水分解が可能です。 1. 強酸と弱塩基によって形成される塩:  2. 強塩基と弱酸によって形成される塩: CH3COONa + HOH → CH3COOH + NaOH。 3. 弱酸と弱塩基によって形成される塩。 シアン化アンモニウムは、次の反応によって加水分解されます。 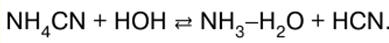 4.強酸と強塩基によって形成される塩。 NaCl、KNO3は加水分解を受けません。 塩の加水分解のメカニズムは、塩イオンとその水和シェルとの偏光相互作用にあります。 この相互作用が強いほど、加水分解は激しくなります。 考慮された加水分解のすべてのケースは、XNUMX 酸塩基と XNUMX 塩基酸によって形成された塩に関するものでした。 多塩基酸と多酸塩基の塩は段階的に加水分解され、酸性塩と塩基性塩を形成します。 定量的には、CO平衡としての加水分解は、加水分解の程度と加水分解定数によって特徴付けられます。 加水分解の程度は、溶質の総量に対する加水分解された物質の量の比率によって測定されます。 加水分解の程度は、塩の性質、濃度、温度によって異なります。 質量作用の法則によれば、加水分解の程度は溶液の希釈とともに増加します。 なので、ある濃度で Na2CO3 0,001mol/l、加水分解度は34%。 一般に、次の規則性が成り立ちます。 1. 塩の加水分解は、温度の上昇と溶液の希釈とともに増加するはずです。 2. 可逆的な加水分解では、ル シャトリエの原理に従い、酸性化 (この塩が強酸と弱塩基によって形成される場合、H イオンが蓄積する場合) またはアルカリ化 (塩が弱酸と強塩基では、OH イオンが蓄積します)。 3. 塩の加水分解は、その結果、反応領域から除去される難溶性またはガス状の生成物が形成されます (平衡シフトの原理)、不可逆的です。 たとえば、Pb(SO4)2 PbOの沈殿物の形成のために完全に進行します2: Pb(SO4)2 +2Н2O→PbO2 + 2H2SO4. 加水分解は、多くのクラスの無機および有機化合物の特徴です。 無機化合物の加水分解は、それらの毒性を評価するために重要です。 有機化合物の加水分解は、木材、脂肪、エステルなどから貴重な製品を得るために使用されますが、加水分解は生物の生活において特に重要な役割を果たします。 26.沈殿および溶解反応 電解液中で起こる交換反応には、析出反応と溶解反応がある。 沈殿反応には沈殿が伴います。 沈殿物の溶解を伴う反応は、溶解反応と呼ばれます。 難溶性電解質の堆積物とその上の飽和溶液からなるシステムが広く使用されています。 このようなシステムでは、飽和溶液と沈殿物の間に動的平衡が確立されます。 溶解度が低いため、溶液中の難溶性電解質の濃度は非常に低いため、溶液中で完全に解離していると見なすことができます。 換言すれば、飽和溶液中の動的平衡は、物質の固相と溶液中に通過したイオンとの間に確立される。 たとえば、AgCl の飽和溶液では、次の平衡が発生します。 AgCl(T)→Ag+(P) + Cl(R). 一定値としての固相 AgCl の濃度は、平衡定数の式から除外されます。 その結果、平衡定数は溶液中のイオン濃度の積によってのみ決定され、定数または溶解度積と呼ばれます。 一般に、Ktn Anm 電解質の場合、溶解度定数はイオン濃度の化学量論積によって決定されます。 Кпр= [Ktm+ ]n[NSn]m この値は、異物がない場合の一定温度での電解質の溶解度を示します。 Kコンスタンシーпр 溶液中の個々のイオンの濃度が一定であることを意味するものではありません。 したがって、たとえばAgNOを添加することにより、AgClの飽和溶液中のAgイオンの濃度を高めることが可能3 、一方、ルシャトリエの原理による平衡は左にシフトし、イオン堆積率の増加につながります。 しばらくすると、AgCl の溶解速度と Ag および Cl イオンの沈殿が等しくなります。 新たに確立された平衡は、以前と同様に、値 K によって特徴付けられます。пр(AgCl)ですが、AgイオンとClイオンの平衡濃度は変化します。 したがって、K に基づいてпр XNUMX つのルールに基づいて、電解質沈殿物の形成と溶解を予測することができます。 1. 電解質は、溶液中のイオン濃度の化学量論積が溶解度定数より大きい場合に沈殿します。 2.電解質沈殿物は、溶液中のその構成イオンの濃度の化学量論的積が溶解度定数よりも小さくなると溶解します。 沈殿反応は、医薬品の定量分析に使用される沈殿法の基礎です。 沈殿法は、尿、胃液、血液中の塩化物の臨床分析や衛生業務、つまり飲料水の分析に使用されます。 科学者たちは、元素の天然化合物の水への溶解度の違いが、生体内の元素の含有量に大きな影響を与えたと考えています。 水中の化合物の溶解度と、多くの元素のイオンの毒性効果の間には密接な関係があります。 例えば、アルの導入。3 + 難溶性リン酸アルミニウムAlPO4の形成による体内への 27. レドックス反応 無機化学の基本概念の XNUMX つは、酸化状態 (CO) の概念です。 化合物中の元素の酸化状態は、元素の原子の形式電荷であり、価電子がより高い相対電気陰性度 (REO) を持つ原子に移動し、化合物分子内のすべての結合がイオン性であるという仮定から計算されます。 元素 E の酸化状態は、元素記号の上部に数字の前に「+」または「-」記号を付けて表示されます。 実際に溶液または結晶中に存在するイオンの酸化状態は、その電荷数と一致し、同様に番号の後に「+」または「-」記号を付けて表示されます (例: Cl)。、Ca2+. ストック法は、元素の記号であるMn (VII)、Fe (III) の後にローマ数字で酸化度を示すためにも使用されます。 分子内の原子の酸化状態の符号の問題は、分子を形成する相互接続された原子の電気陰性度の比較に基づいて解決されます。 この場合、電気陰性度が低い原子は正の酸化状態を持ち、電気陰性度が高い原子は負の酸化状態を持ちます。 酸化状態は元素の価数では特定できないことに注意してください。 原子価は、特定の原子が他の原子に結合する化学結合の数として定義され、ゼロになることはできず、「+」または「-」記号もありません。 酸化状態は正の値と負の値の両方を取ることができ、ゼロまたは小数値を取ることもできます。 つまり、CO 分子内では2 Cの酸化状態は+4で、CH分子では4 C の酸化状態は 4 です。両方の化合物の炭素 4 a の原子価は IV です。 上記の欠点にもかかわらず、酸化度の概念の使用は、化合物の分類および酸化還元反応の式の定式化において便利です。 元素が酸化されると、酸化状態が増加します。つまり、反応中の還元剤が酸化状態を増加させます。 逆に、元素が還元されると、酸化状態が減少します。つまり、反応中に酸化剤が酸化状態を減少させます。 したがって、酸化還元反応の次の定式化を与えることが可能です。酸化還元反応は、反応物質を構成する元素の原子の酸化状態の変化で発生する反応です。 28. 酸化剤および還元剤 生成物と酸化還元反応の方向を予測するために、典型的な酸化剤は原子が 3,0 を超える大きな EER (VIA および VIIA グループの要素) を持つ単純な物質であることを覚えておくと便利です。 これらのうち、最も強力な酸化剤は、フッ素 (OEO = 4,0)、酸素 (OEO = 3,0)、塩素 (OEO = 3,5) です。 重要な酸化剤には PbO が含まれます2 、KMnO4 、Ca(SO4)2 、K2クロム2O7 、HClO、HClO3、KSIO4、ナビオ3、H2SO4(終わり)、HNO3(終了) な2O2 、(NH4)2S2O8 、KSIO3 、H2O2 およびそれ以上の CO 原子を含むその他の物質。 典型的な還元剤には、原子のEERが1,5未満の単純な物質(IAおよびIIAグループの金属およびその他のいくつかの金属)が含まれます。 重要な還元剤にはHが含まれます2S、NH3、HI、KI、SnCl2 、FeSO4 、C、H2 、CO、H2SO3 、Cr2(SO4)3 、CuCl、Na2S2O3 低CO原子を含むその他の物質。 それぞれ最大および最小の酸化状態の原子を含む物質は、K などの酸化剤にしかなれません。2SG2O7 、KMPO4 、PbO2 、HClO4 またはNHなどの還元剤のみ3 、H2市。 中間の酸化状態の原子を含む物質は、酸化状態を上げたり下げたりすることができます。彼らよりも活性、還元剤)。 このような物質は酸化還元二重性を示します。 酸化還元反応式を作成する場合、電子平衡法とイオン電子法(半反応法)の XNUMX つの方法が使用できます。 溶液中の酸化還元プロセスのより正確な考え方は、イオン電子法によって提供されます。 この手法では、実際に溶液中に存在する変化をイオンや分子によって予測します。 反応生成物の予測に加えて、電気分解中およびガルバニ電池で発生する酸化還元プロセスを理解するには、イオン半反応式が必要です。 この方法は、プロセスの参加者としての環境の役割を反映しています。 そして最後に、この方法を使用する場合、形成されるすべての物質を事前に知る必要はありません。それらの多くは酸化還元反応の式を編集することによって得られるからです。 半反応は、レドックス反応中に発生する実際のプロセスを反映していますが、レドックス反応の実際の段階 (メカニズム) とは識別できないことに注意してください。 多くの要因が酸化還元反応の性質と方向に影響を与えます。反応物の性質、媒体の反応、濃度、温度、および触媒です。 速度論的要因をさらに考慮する必要があるため、負の値が常に特定の方向の反応の実際の経過について明確な決定につながるとは限らないことに留意する必要があります。 29. 酸化還元過程の生物学的意義 レドックス反応は、ある分子またはイオンから別の分子またはイオンへの電子の移動を伴う化学プロセスです。 酸化還元反応では、酸化と還元というXNUMXつの相互に関連するプロセスが発生します。 酸化は電子を失うプロセスです。 回復は、電子を追加するプロセスです。 原子またはイオンが電子を供与する物質は、還元剤と呼ばれます。 原子またはイオンが電子を追加する (または共通の電子対を引き寄せる) 物質は、酸化剤と呼ばれます。 亜鉛とCuSOの反応4 Cu2 + 電子を追加: 自分自身2+ + 2え -Si0 . 亜鉛原子は電子を供与します: Zn0 -亜鉛2 + 2え. したがって、CuSO4 - 酸化剤、Zn - 還元剤。 動物の生体における重要なプロセスは、炭水化物、脂肪、アミノ酸などの基質物質の酵素酸化反応です。 これらのプロセスの結果、生物は大量のエネルギーを受け取ります。 成人男性の全エネルギー必要量の約 90% は、炭水化物と脂肪の酸化によって組織内で生成されるエネルギーによって満たされます。 残りのエネルギー - 約 10% - はアミノ酸の酸化分解から得られます。 生物学的酸化は、多数の酵素が関与する複雑なメカニズムを通じて進行します。 ミトコンドリアでは、有機基質からの電子移動の結果として酸化が起こります。 電子伝達体として、ミトコンドリアの呼吸鎖には、電子を運ぶように設計されたさまざまな官能基を含むさまざまなタンパク質が含まれています。 ある中間体から別の中間体へと鎖に沿って移動すると、電子は自由エネルギーを失います。 呼吸鎖を介して酸素に移動する電子のペアごとに、3 つの ATP 分子が合成されます。 2 個の電子が酸素に移動する際に放出される自由エネルギーは 220 kJ/mol です。 標準的な条件下での 1 つの ATP 分子の合成には、30,5 kJ が消費されます。 このことから、220 対の電子の移動中に放出される自由エネルギーのかなりの部分が ATP 分子に保存されることが明らかです。 これらのデータから、初期還元剤から酸素への多段階電子移動の役割も明らかになります。 1 対の電子が酸素に移動する際に放出される大きなエネルギー (XNUMX kJ) は、酸化の個々の段階に対応するいくつかの部分に分割されます。 このような XNUMX つの段階で、放出されるエネルギーの量は、XNUMX つの ATP 分子の合成に必要なエネルギーにほぼ相当します。 酸化還元反応は、酸化還元法の基礎であり、Ca イオン、尿酸、カタラーゼおよびペルオキシダーゼ酵素、血液中の糖を測定する臨床分析、および水の酸化性、水分の含有量を測定する衛生分析で使用されます。漂白剤中の活性塩素、家庭用飲料水中の残留塩素、水 30.化学結合とその実験的特徴 現代の原子モデルの開発とそれに基づく個々の原子の特性の予測は、量子力学の非常に重要な成果です。 しかし、地球環境下では孤立した原子が見つかることはほとんどありません。 私たちを取り囲む無生物および生きた自然の体は、さまざまな分子で構成されています。 A. M. Butlerov (1828-1886) は、有機物質の化学構造の理論を作成しました (1861)。 それ以来、「原子価」と「化学結合」の概念が徐々に化学に入り始めました。 原子価とは、原子が特定の数の他の原子を結合して分子を形成する能力です。 価数は元素記号の隣のダッシュで示されます。 水素 (H) は 0 価、酸素 (O=) は XNUMX 価です。 原子価バーの数によって、特定の原子が他の原子と形成できる化学結合の数が決まります。 化学結合は、電子と原子核の間の一連の相互作用であり、原子が結合して分子になります。 化学結合の性質は、さまざまな方法で研究されています。 化学的方法の助けを借りて、原子の結合数(原子価)とそれらの反応性が決定されます。 物理的方法を使用して、化学結合の長さ、強度、方向、および極性が決定されます。 化学結合長 rс 結合した原子の核間の距離によって測定される値と呼ばれます。 化学結合長の単位 gс ピコメートルの使い勝手(午後):1 pm = 1012 メートル 化学結合強度 Eс - エンタルピー ΔЕ で測定された値с コネクション形成。 化学結合強度の単位としてEс kJ/mol を使用します。 化学結合の向きс - 特定の原子の結合の方向と分子の隣接原子との間の角度によって測定される値。 角 ac は価電子角と呼ばれます。 結合角単位 aс - 程度。 化学結合の極性 μс - この接続の電気モーメントによって測定された値。 絶対値が等しく符号が逆である XNUMX つの電荷 +q と ־q の電気モーメントは、μ = qr に等しくなります。ここで、r は電荷間の距離です。 これら XNUMX つの電荷は電気双極子を形成します。 電気陰性度 (EOE) の異なる 2 つの原子が結合すると、化学結合は分極します。 その結果、OEO値が大きい原子には過剰な負電荷δが現れ、OEO値が低い別の原子には過剰な正電荷+δが現れます。 接続の極性は次の式を使用して計算されます。 μс = δrс. 化学結合の極性を測定する単位として非系統デバイ単位 (D) を使用すると便利です (1 D = 3,3 x 1030 C/m)。 水分子の O-H 結合の極性は μ です。彼 = 1,5D。 化学結合の研究は、ほとんどの場合、異なる化合物における同じ化学結合の長さ、強度、方向、極性がほぼ同じ値を持つことを示しました。 したがって、原子間の特定の結合の形成につながる相互作用は、異なる分子でも同じ性質のものであるということになります。 化学結合の量子力学理論は、この事実の説明を提供します。 31. 水素結合。 分子間および分子内水素結合 分子内の化学結合は通常非常に強く、そのエネルギーは 100 ~ 150 kJ/mol の範囲です。 さらに、いわゆる水素結合があり、その強度は 10 ~ 40 kJ/mol です。 これらの結合の長さは、それぞれ 270 ~ 230 pm です。 原子間の水素結合 EА およびEВ Eに結合した水素原子によって行われる相互作用と呼ばれるА またはEВ 化学結合。 一般的な場合の水素結合の画像は、次の形式になります。 ЭА-N...Eв.. 明らかに、水素結合は 3 中心です。XNUMX つの原子がその形成に関与しているためです。 このような結合が発生するためには、原子 EА およびEВ 電気陰性度が高い。 これらは、最も負の元素の原子です: 窒素 (REO = 3,0)、酸素 (REO = 3,5)、フッ素 (REO = 4,0)、および塩素 (REO = 3,0)。 水素結合は、2s-AO 水素と XNUMX つの XNUMXpAO 原子 E の組み合わせの結果として形成されます。А およびEВ; 2つの軌道はXNUMX本の直線に沿って配置されます。 したがって、水素結合は線形です。 水素結合は次のように呼ばれます。 1) 原子 E の場合、分子内А およびEВ 、この結合によって接続され、同じ分子に属します。 2)分子間、原子Eの場合А およびEВ 異なる分子にあります。 分子内水素結合は、たとえばポリマータンパク質分子のらせん構造を決定するなど、重要な生物学的役割を果たします。 タンパク質では、これらはアミノ酸残基間の N-H...O 結合です。 分子間の水素結合も同様に重要です。 それらの助けを借りて、核酸の鎖が接続されて二重らせんを形成します。 核酸塩基間の結合には、NHN と NH-O の XNUMX 種類があります。 分子の熱運動の平均運動エネルギーは 3/2RT のオーダーです。 人間の体温が 37°C (310°K) の場合、これは約 4 kJ/mol です。 水素結合の強度は 10 ~ 40 kJ/mol の範囲にあるため、周囲の分子の絶え間ない衝撃に耐え、ポリマーの生物学的構造の形状の一定性を確保するのに十分な強度があります。 同時に、活性分子の衝突により、水素結合が定期的に切断され、再び復元され、さまざまな生命プロセスの流れが確保されます。 考慮された例は、VS 法よりも MO LCAO 法の適用範囲が広いことを明確に示しています。 それにもかかわらず、VS 法は、複雑な化合物を含む多くの物質の特性と構造を予測するためにうまく使用できます。 32.環境と人体のマクロ要素とミクロ要素 人体に含まれる化学元素にはさまざまな分類があります。 したがって、V. I. Vernadskyは、生物の平均含有量(質量分率w、%)に応じて、XNUMX日システムに従って要素を分割しました。 この分類によれば、生物に含まれる元素は、マクロ元素、ミクロ元素、ウルトラミクロ元素の XNUMX つのグループに分けられます。 大量栄養素 これらは、本体の含有量が 10 を超える要素です。2%。 これらには、酸素、炭素、水素、窒素、リン、硫黄、カルシウム、マグネシウム、ナトリウム、および塩素が含まれます。 トレース要素 これらは、本体のコンテンツが 10 の範囲内にある要素です。3 10へ5%。 これらには、ヨウ素、銅、ヒ素、フッ素、臭素、ストロンチウム、バリウム、コバルトが含まれます。 超微量元素 これらは、本体のコンテンツが 10 未満の要素です。5%。 これらには、水銀、金、ウラン、トリウム、ラジウムなどが含まれます。 現在、ウルトラマイクロエレメントはマイクロエレメントと組み合わされてXNUMXつのグループになっています。 この分類は、生体内の元素の含有量のみを反映しており、この元素またはその元素の生物学的役割および生理学的重要性を示すものではありません。 V. V. Kovalsky は、生命にとっての重要性に基づいて、化学元素を XNUMX つのグループに分けました。 重要な(かけがえのない)要素 それらは人体に常に含まれており、酵素、ホルモン、ビタミンの一部です:H、O、Ca、N、K、P、Na、S、Mg、d、C、I、Mn、Cu、Co、Fe、 Zn、Mo、V。それらの欠乏は、通常の人間の生活の混乱につながります。 不純物元素 これらの元素は、動物や人間の体内で常に発見されています: Ga、Sb、Sr、Br、F、B、Be、Li、Si、Sn、Cs、Al、 Ba、Ge、As、Rb、Pb、Ra、Bi、Cd、Cr、Ni、Ti、Ag、Th、Hg、U、Se。 それらの生物学的役割は、ほとんど理解されていないか不明です。 不純物元素 Sc、Tl、In、La、Pr、Sm、W、Re、Tbなど。人間や動物に見られます。 数と生物学的役割に関するデータはまだ明らかにされていません。 さまざまな細胞や生物の構築と生命活動に必要な要素は、生体要素と呼ばれます。 非常に低濃度の微量元素を特定し、それらの生物学的機能を確立することは困難であるため、すべての生物起源元素を正確に列挙することは依然として不可能です。 24 要素の生物原性が確実に確立されました。 これらは、最初のグループの要素と、XNUMX 番目のグループの一部の要素です (Kowalski によると)。 33. 人体の最も重要な生体要素のトポグラフィー 人間の臓器は、それ自体でさまざまな化学元素を異なる方法で濃縮します。つまり、ミクロ要素とマクロ要素は、異なる臓器や組織間で不均一に分布しています。 ほとんどの微量元素は、肝臓、骨、筋肉組織に蓄積します。 これらの組織は、多くの微量元素の主要な貯蔵所(貯蔵庫)です。 元素は特定の器官に対して特異的な親和性を示し、それらの器官に高濃度で含まれる場合があります。 亜鉛は膵臓に、ヨウ素は甲状腺に、フッ素は歯のエナメル質に、アルミニウム、ヒ素、バナジウムは髪や爪に蓄積し、カドミウム、水銀、モリブデンは腎臓に、錫は腸に集中していることはよく知られています。組織、ストロンチウム - 前立腺、骨組織、バリウム - 網膜色素、臭素、マンガン、クロム - 下垂体など。 生物では、微量元素は結合状態にある場合もあれば、遊離イオン形態の形をとる場合もあります。 脳組織中のシリコン、アルミニウム、銅、チタンはタンパク質と複合体の形をしているのに対し、マンガンはイオンの形をしていることが知られています。 水素と酸素は多量元素です。 これらは水の一部であり、成人の体内では平均約 65% が水に含まれています。 水は人間の臓器、組織、体液全体に不均一に分布しています。 したがって、胃液、唾液、血漿、リンパ液では89,5〜90%が水で構成され、尿では脳の灰白質、腎臓では80%、脳の白質、肝臓、皮膚、脊髄では70%が構成されています。 、筋肉、肺、心臓 - 80-XNUMX%。 何よりも、水の40%が骨格に含まれています。 マクロ元素 - 炭素、水素、酸素、窒素、硫黄、リン - は、体のタンパク質、核酸、その他の生物学的に活性な化合物の一部です。 タンパク質中の炭素含有量は51〜55%、酸素 - 22〜24%、窒素 - 15〜18%、水素 - 6,5〜7%、硫黄 - 0,3〜2,5%、リン - 約0,5%です。 炭水化物の組成には炭素、水素、酸素も含まれていますが、動物組織におけるその含有量はわずかであり、約2%です。 これらの要素は脂質(脂肪)の一部です。 さらに、リン脂質にはリンがリン酸基の形で含まれています。 脂質は脳 (12%) に最も集中し、次に肝臓 (5%)、牛乳 (2 ~ 3%)、血清 (0,6%) に集中します。 しかし、リンの大部分 (600 g) は骨組織に含まれています。 これは人体に存在する全リンの質量の 85% を占めます。 リンは歯の硬組織にも集中しており、カルシウム、塩素、フッ素とともにヒドロキシル、塩素、一般式 Ca のフルオロアパタイトの形で含まれています。5 (PO4)3X、ここで X = OH、CI、F、それぞれ。 カルシウムは主に骨に集中しており、歯組織にも集中しています。 ナトリウムと塩素は主に細胞外液に含まれ、カリウムとマグネシウムは主に細胞内液に含まれます。 フッ化物の形で、ナトリウムとカリウムは骨や歯の組織の一部です。 リン酸Mgとしてのマグネシウム3 (PO4)2 歯の硬組織に含まれています。 ホルモンは、体内のマクロ要素とミクロ要素の特定の内容を維持することに関与しています。 34.体内の化学元素の生物学的役割 人体における化学元素の生物学的役割は非常に多様です。 主要栄養素の主な機能は、組織を構築し、一定の浸透圧、イオンおよび酸塩基組成を維持することです。 微量元素は、酵素、ホルモン、ビタミン、錯化剤または活性化剤としての生物学的に活性な物質の一部であり、代謝、生殖プロセス、組織呼吸、および有毒物質の中和に関与しています。 微量元素は、血管や組織の造血、酸化、還元、透過性のプロセスに積極的に影響を与えます。 マクロおよびミクロ元素 - カルシウム、リン、フッ素、ヨウ素、アルミニウム、ケイ素 - は、骨と歯の組織の形成を決定します。 さまざまな微量元素の欠乏または過剰な蓄積に関連する多くの疾患が確認されています。 フッ化物欠乏は虫歯を引き起こし、ヨウ素欠乏は風土性甲状腺腫を引き起こし、過剰なモリブデンは風土性痛風を引き起こします。 このような種類のパターンは、人体が生体要素の最適濃度のバランス、つまり化学的恒常性を維持しているという事実に関連しています。 この元素の不足や過剰によりバランスが崩れると、さまざまな病気の原因となります。 炭水化物、脂肪、タンパク質、核酸を構成する有機物質(炭素、水素、窒素、酸素、硫黄、リン)の XNUMX つの主要な主要元素に加えて、カルシウム、塩素などの無機多量元素も人間と動物の通常の栄養に必要です。 、マグネシウム、カリウム、ナトリウム - そして微量元素 - 銅、フッ素、ヨウ素、鉄、モリブデン、亜鉛、そしておそらく(動物に対して証明されている)セレン、ヒ素、クロム、ニッケル、シリコン、スズ、バナジウム。 人体に含まれる微量元素の含有量や割合の分析は、法医学検査にも利用されています。 たとえば、アルコール中毒の場合、エチルアルコールの影響下で、肝臓のカルシウム含有量が増加し、ナトリウムとカリウムが少なくなります。 同時に、逆に心臓や腎臓ではカルシウム含有量が減少します。 鉄、銅、フッ素、亜鉛、ヨウ素、カルシウム、リン、マグネシウムなどの元素が食事に含まれていないと、人間の健康に深刻な影響を及ぼします。 ただし、欠乏だけでなく、過剰な生体要素も体に有害であることを覚えておく必要があります。これは、化学的恒常性を乱すためです。 ごくわずかな量で不可欠なミネラル成分は、高濃度で有毒になります。 多くの元素(銀、水銀、鉛、カドミウムなど)は、微量であっても体内に入ると深刻な病理学的現象を引き起こすため、毒性があると考えられています。 さまざまな元素とその化合物が医薬品として広く使用されています。 したがって、化学元素の生物学的役割の研究、これらの元素の交換と他の生理活性物質(酵素、ホルモン、ビタミン)との関係の解明は、新薬の作成と最適な投与計画の開発に貢献します治療目的と予防目的の両方。 35. S元素とその化合物 水は、地球上で最も重要かつ広範囲に存在する水素化合物の 75 つです。 水域は地球の表面のほぼ 65% を占めています。 成人の体内には平均して67〜4%の水分が含まれており、胎児(94か月) - 74%、新生児 - XNUMX%が含まれています。 体内のすべての化学反応は、水生環境でのみ発生します。 水なしの生活は不可能です。 蒸留水は薬局方調剤です。 医療現場では、別の水素化合物である過酸化水素H2が使用されます。 この化合物は代謝の重要な副産物です。 過酸化水素は無色透明の液体です。 皮膚や粘膜に触れると火傷を起こす。 分子H2О2 極性。 酸素原子上の孤立電子対の存在により、過酸化水素と配位子(電子受容体)との供与体・受容体結合を形成することが可能になります。 H中の酸素の酸化状態2О2 は1に等しい、つまり、水中の酸素の酸化状態(2)と元素状酸素Oの中間値を持ちます。2 . このことから、過酸化水素は酸化剤の性質と還元剤の性質の両方を示すことができる(レドックス二重性)。 ただし、標準的なレドックス半反応電位から判断すると、酸化特性は過酸化水素の特徴です。 純粋な過酸化水素は熱力学的に不安定で、放置すると爆発的に水と酸素に分解し、大量の熱を放出します。 過酸化水素水溶液はより安定しており、涼しい場所で長期間保存できます。 過酸化水素は通常、30% 水溶液、ペルヒドロールの形で販売されます。 過酸化水素の分解のコプロセスは、重金属の塩の存在下で大幅に加速されます。 過酸化水素の金属イオン触媒分解はラジカルの形成につながる可能性があり、その中で最も重要なものは水酸化物HOとヒドロペルオキシドです。 毒性は、2О2 とO2 細胞膜の脂質層と相互作用し、それらを損傷します。 医療現場では、過酸化水素は主に外用殺菌剤として使用されています。 アクションH2О2 過酸化水素の酸化能力とその還元生成物である水の無害性に基づいています。 創傷を治療する場合、放出された酸素はXNUMXつの役割を果たします。 1)抗菌、消臭、脱色効果があり、微生物体を殺します。 2) 泡を形成し、組織崩壊粒子の懸濁状態への移行と創傷の洗浄に寄与します。 薬局方の製剤として、過酸化水素の3%水溶液が使用され、過酸化水素の6%溶液が毛髪の脱色に使用されます。 過酸化水素は 30% 溶液の形で、扁平苔癬の疣贅の治療や若々しい疣贅の除去に使用されます。 36. IAグループのs元素(リチウム、ルビジウム、セシウム、フランシウム)の生物学的役割 人体内の含有量に関しては、ナトリウム(0,08%)とカリウム(0,23%)が多量元素であり、残りのアルカリ金属はリチウム(10%)です。4%)、ルビジウム(105%)、セシウム (104%)-要素をトレースします。 リチウム 人体のリチウム含有量は約 70 mg (10 mmol) - 104% です。 高等動物のリチウム化合物は、肝臓、腎臓、脾臓、肺、血液、乳汁に濃縮されています。 リチウムの最大量は人間の筋肉にあります。 微量元素としてのリチウムの生物学的役割は、まだ完全には解明されていません。 細胞膜のレベルでは、Li イオン (十分な濃度) が細胞に浸透する際にナトリウム イオンと競合することが証明されています。 明らかに、細胞内の Na イオンの Li イオンによる置換は、リチウム化合物のより大きな共有原子価と関連しており、その結果、それらはリン脂質によりよく溶解します。 一部のリチウム化合物は、躁うつ病の患者にプラスの効果をもたらすことが確立されています。 消化管から吸収されたリチウムイオンは、血液中に蓄積します。 Liイオンの濃度が0,6mmol/l以上になると、情緒的緊張が低下し、躁状態が弱まります。 同時に、血漿中の Li イオンの含有量を厳密に管理する必要があります。 Li イオンの濃度が 1,6 mmol/l を超える場合、負の現象が発生する可能性があります。 ルビジウムとセシウム 人体のルビジウムの含有量によると(105%) およびセシウム (104%)微量元素に属します。 それらは常に体内に含まれていますが、それらの生物学的役割はまだ解明されていません。 カリウムの完全な類似体であるルビジウムは、細胞内液にも蓄積し、さまざまなプロセスで同量のカリウムを置き換えることができます。 放射性同位元素 13rCと 87Rb は、悪性腫瘍の放射線療法やカリウム代謝の研究に使用されています。 それらは急速に分解されるため、長期にわたる有害な影響を恐れることなく体内に導入することさえできます. フランス これは、人工的な手段によって得られた放射性化学元素です。 フランシウムは、発生の初期段階で腫瘍に選択的に蓄積できるという証拠があります。 これらの観察は、がんの診断に役立つ可能性があります。 したがって、IA族元素のうち、Li、Rb、Csは生理活性があり、NaとKは重要である。 Li と Na の物理化学的性質の類似性は、それらの原子の電子構造の類似性により、カチオンの生物学的作用 (細胞外液への蓄積、交換可能性) にも現れます。 長期間の元素のカチオンの生物学的作用の同様の性質 - K+、Rb+、Cs+ (細胞内液への蓄積、互換性)も、それらの電子構造と物理化学的特性の類似性によるものです。 これは、リチウムおよびルビジウム塩による中毒の場合にナトリウムおよびカリウム製剤を使用するための基礎です。 37. IAグループのs元素(ナトリウム、カリウム)の生物学的役割 体重70kgの人体のナトリウム含有量は約60g(2610mmol)、0,08%です。 この量のうち、ナトリウムの 44% は細胞外液に存在し、9% は細胞内液に存在します。 残りのナトリウム量は、体内の Na イオンの沈着部位である骨組織にあります。 骨組織に含まれるナトリウムの約 40% は代謝プロセスに関与しており、そのおかげで骨格は Na イオンの供与体または受容体のいずれかとなり、細胞外液中の Na イオン濃度を一定に維持するのに役立ちます。 ナトリウムは主要な細胞外イオンです。 人間の体内では、ナトリウムは主に塩化物、リン酸塩、炭酸水素塩などの可溶性塩の形で存在します。 ナトリウムは、血清、脳脊髄液、眼液、消化液、胆汁、腎臓、皮膚、骨組織、肺、脳など、全身に分布しています。 Na イオンは、人体の内部環境の恒常性を確保する上で重要な役割を果たし、生体液の浸透圧を一定に維持することに関与しています (浸透圧恒常性)。 Na イオンは水分代謝の調節に関与し、酵素の機能に影響を与えます。 K、Mg、Ca、Cl イオンとともに、Na イオンは神経インパルスの伝達に関与し、筋肉細胞の正常な興奮性を維持します。 体内のナトリウム含有量が変化すると、神経系、心血管系およびその他の系、平滑筋および骨格筋の機能障害が発生します。 塩化ナトリウム NaCl は、胃液の塩酸の主な供給源です。 ナトリウムは主に食卓塩の形で人体に入ります。 この要素の平均摂取量は 1 ~ 4 g に達しますが、体の真のナトリウムの 7 日必要量は XNUMX g です. NaCl の継続的な過剰摂取は高血圧の原因となります. 微生物細胞がアルカリにさらされると、細胞タンパク質の沈殿が起こり、その結果、微生物が死滅します。 硫酸ナトリウム(グラウバー塩)Na2SO4 ×10H2Oは下剤として使用されます。 四ホウ酸ナトリウムNa2B4О7 ×10H2Oは、すすぎ、洗浄、潤滑のための防腐剤として外用されます。 10%溶液の形の水酸化ナトリウムは、コバルトクロム合金から鋳造補綴物を製造する際に難治性モデルを鋳造するための整形外科診療で使用されるシリンの一部です。 体重70kgの人体のカリウム含有量は約160g(4090mmol)、0,23%です。 カリウムは主要な細胞内カチオンであり、総活性細胞カチオンの 2/3 を占めます。 体内に含まれるカリウムの総量のうち、98%は細胞内に存在し、細胞外液にはわずか約2%しか存在しません。 カリウムは体全体に分布します。 その地形:肝臓、腎臓、心臓、骨組織、筋肉、血液、脳など。Kイオンは、筋肉の収縮、心臓の正常な機能、神経インパルスの伝導、代謝反応などの生理学的プロセスにおいて重要な役割を果たします。 K イオンは、細胞内に存在する酵素の重要な活性化因子です。 38. IIAグループのs要素の生物学的役割。 医学におけるそれらの使用(ベリリウム、マグネシウム、カルシウム) ベリリウムは、植物だけでなく動物にも見られます。 生物中のベリリウムの含有量は107%、つまり不純物超微量元素です。 ベリリウムの生物学的役割は十分に研究されていません。 ベリリウム化合物は毒性があり、多くの病気 (ベリリウムくる病、ベリリウム症など) を引き起こします。 ベリリウムの揮発性化合物は特に有毒です。 生理学的プロセスに対する Be2 + の悪影響は、その化学的性質によって説明されます。 マグネシウムは正式には主要栄養素として分類されます。 体内の総含有量は0,027%(約20g)です。 人体内のマグネシウムの分布は次のとおりです。マグネシウムは歯と骨組織の象牙質とエナメル質に最も多く集中しています。 また、膵臓、骨格筋、腎臓、脳、肝臓、心臓にも蓄積します。 成人の場合、0,7 日あたりのマグネシウムの必要量は約 XNUMX g です。Mg イオンは、K イオンと同様に細胞内の陽イオンです。 体液や体の組織では、マグネシウムは水イオンの形とタンパク質結合状態の両方で10未満の量で見られます2%、つまり、本質的には微量元素です。 細胞内の Mg イオンの濃度は、細胞外液の約 2,5 ~ 3 倍です。 マグネシウムイオンは、人体において重要な生物学的役割を果たしています。 Mg のイオン半径が小さく、イオン化エネルギーが高いため2+ Ca イオンよりも強い結合を形成するため、酵素プロセスのより活性な触媒となります。 Mg イオンはさまざまな酵素系の一部であり、その必須成分および活性化因子です (カルボキシペプチダーゼ、コリンエステラーゼなどの酵素やその他の酵素は Mg イオンに特異的です)。 Mg が過剰になると、多くの酵素反応を伴う ATP 加水分解が起こり、その結果ヒドロホスファチオン HPO2 が形成され、大量のエネルギーが放出されます。2+. カルシウムは多量栄養素です。 体内の総含有量は1,4%です。 カルシウムは人体のあらゆる細胞に存在します。 カルシウムの大部分は、骨および歯の組織に見られます。 平均して、成人は 1 日あたり 0,5 g のカルシウムを消費する必要がありますが、カルシウムの必要量はわずか 50 g であり、食物とともに投与されたカルシウムは腸で吸収されるのはわずか XNUMX% です。 吸収が比較的悪いのは、胃腸管で難溶性リン酸カルシウム Ca が形成されるためです。3(PO4)2 および脂肪酸のカルシウム塩。 体内では、Ca イオンの濃度はホルモンによって調節されています。 成人の骨と歯の中には、約 1 kg のカルシウムが不溶性の結晶性ミネラル、ヒドロキシアパタイト Ca の形で存在しています。10(RO4)6(OH)2 、その形成は、Ca イオンとホスファチオンの相互作用中に起こります。 血液やリンパ中では、カルシウムはタンパク質や炭水化物などと結合して、イオン化状態と非イオン化状態の両方で存在します。血液凝固機構は、イオン化カルシウムの存在に応じていくつかの段階から構成されます。 Ca イオンは、神経インパルスの伝達、筋肉の収縮、心筋の機能の調節に関与します。 セルの内側と外側のCaイオンの濃度はそれぞれ10です。6 および (2,25-2,8) 103 モル/リットル。 カルシウムは細胞内ではほとんど使用されないため、骨や歯などの体内の建築材料として機能します。 骨格は体内のカルシウムの主な貯蔵場所です。 39. VIB グループの d 要素の生物学的役割。 医学におけるそれらの使用 クロムは植物や動物の生物に含まれています。 成人の体には約 6 g の Cr (0,1%) が含まれています。 クロム金属は無毒ですが、Cr(III) および Cr(VI) 化合物は健康に有害です。 それらは皮膚刺激を引き起こし、皮膚炎につながります。 クロム (VI) 誘導体には発がん性があるという仮説があります。 重クロム酸カリウム 0,25 ~ 0,3 g で死亡します。 クロム (VI) 化合物は、殺菌剤 (エッチャント、真菌 - 「キノコ」、カルデレ - 「殺す」) として使用されます。 クロム(III)化合物は植物の成長に有益な効果をもたらします。 モリブデンは「生命の金属」に属し、最も重要な生体元素の 20 つです。 その特別な位置は、25 ~ XNUMX 年前に F. Krin と L. Oril によって指摘されました。 これらの科学者は、地球上の生命の出現は進化によって発生したのではなく、生命が私たちのずっと前に存在していたモリブデン星からの宇宙からの未知の文明によってもたらされたという考えを提唱しました. 生化学的プロセスでは、モリブデンは酸化状態VIおよびVIに関与します。 これらの状態では、安定したオキソフォームを作成します。 モリブデンは安定したオキソ錯体を形成するため、明らかに、オキソ基の転移を確実にする酵素の一部です。 Mo (VI) は血中で優勢です。 配位子が酸素の場合、安定なイソポリモリブデンが形成されます。 食品中のモリブデン含有量が過剰であると Ca 代謝が混乱する2+ とRO4 、骨の強度の低下、つまり骨粗鬆症を引き起こします。 おそらく、リンモリブデン錯体への結合が発生します。 このような錯体は、ヘテロポリモリブデン酸の酸残基と考えることができます。 カルシウムを使用すると、これらの残留物は不溶性の結晶を形成します。 これらの結晶が尿酸塩の沈着を開始し、痛風を引き起こす可能性があります。 痛風は関節を変形させ、その文字通りの翻訳「足の罠」を正当化します。 酸素錯体に加えて、モリブデンはハロゲン化物(Hal)、チオシアン酸塩(NCS)、およびシアン化物(CN)錯体を形成します。 モリブデンは、さまざまな酵素の構成成分です。 人体では、これらにはアルデヒドヒドロキシダーゼ、キサンチンデヒドロゲナーゼ、およびキサンチンオキシダーゼが含まれます。 キサンチンオキシダーゼ (COX) の分子量は 250 a.u. e.m. これは哺乳類のモリブデン含有酵素です。 キサンチンや他のプリン、アルデヒドの酸化を触媒することができます。 ヒポキサンチンとキサンチンから尿酸への変換は、キサンチンオキシダーゼによって触媒されます。 触媒プロセス中に、モリブデンはキサンチンの窒素および酸素と結合を形成すると考えられます。 モリブデンは植物の最も重要な微量元素です。なぜなら、その関与を伴う生物学的に活性な物質は穏やかな窒素固定を提供するからです。それらはそれをアンモニアまたは窒素含有製品に変換します。 他の工業的に重要な金属と比較して、モリブデンは毒性が低いです。 食事によるモリブデンの摂取量は 0,1 ~ 0,3 mg/日ですが、XNUMX 日に必要な摂取量は確立されていません。 モリブデン欠乏症は、組織のキサンチンオキシダーゼ活性の低下を引き起こします。 モリブデンの過剰含有は骨粗鬆症を引き起こします。 タングステンは微量元素です。 体内でのその役割はよく理解されていません。 陰イオン型のタングステンは消化管で簡単に吸収されます。 金属タングステンとそのカチオン型は体内に吸収されません。 哺乳類のタングステン恒常性に関する情報はありません。 40. マンガン化合物の生物学的役割。 医学におけるそれらの使用 グループVIIBの元素のうち、マンガンだけが生体元素であり、生物の正常な過程に必要なXNUMXの「生命の金属」のXNUMXつです. 成人の体内には12mgが含まれています。 マンガンは骨 (43%) に集中しており、残りは脳を含む軟組織に存在します。 体内では、マンガンはタンパク質、核酸、ATP、ADP、個々のアミノ酸と金属錯体を形成します。 マンガン金属酵素アルギナーゼ、コリンエステラーゼ、ホスホグルコムターゼ、ピルビン酸カルボキシラーゼを含みます。 哺乳動物の体内でアミノ酸が変換される有毒生成物であるアンモニアの結合は、アミノ酸のアルギニンを介して行われます。 アルギナーゼは、肝臓におけるアルギニンの加水分解を触媒する酵素です。 その結果、アルギニンは尿素と環状アミノ酸のオルニチンに分解されます。 尿素は非毒性の水溶性物質です。 血流によって腎臓に運ばれ、尿中に排泄されます。 マンガンの原子半径は 128 pm です。 これは、マンガンがATPとの組み合わせでマグネシウム(原子半径160 pm)を置き換えることができ、体内のエネルギー伝達に大きな影響を与えるという事実を説明しています. Mg および Mn イオンは酵素、ヌクレアーゼも活性化します。 これらの酵素は、十二指腸における DNA および RNA 核酸の加水分解を触媒します。 その結果、これらの生体高分子はモノマー単位、つまりヌクレオチドに分割されます。 特に、そのようなヌクレアーゼはデオキシリボヌクレアーゼであり、Mg の存在下でのみ DNA 加水分解を触媒します。2+ またはMp2+. マンガンは、体内の無機化合物の一部になることもあります。 これは、例えば、難溶性ピロリン酸マンガンマグネシウムMnMgPです。2O7. この塩の結晶は、小胞膜の内面に局在しています。 マンガンと鉄の原子半径のほぼ同じ値は、赤血球ポルフィリン複合体の鉄をマンガンが置き換える能力を説明しています。 同じ理由で、マンガンは亜鉛依存性酵素の亜鉛を置き換えることもできるため、それらの触媒特性が変化します。 過マンガン酸カリウムKMnO4 - 医学で使用される最も有名なマンガン化合物。 KMnOを含む水溶液を使用してください4 0,01-5%。 止血剤として5%溶液を使用します。 過マンガン酸カリウムの溶液には、その高い酸化力によって決定される消毒特性があります。 他のマンガン化合物のうち、貧血の治療に使用される硫酸マンガン(II)と塩化マンガン(II)に注意する必要があります。 生体内のテクネチウムの存在に関するデータはありません。 しかし、ビスフォスフォネートを含むテクネチウム化合物は、放射性同位体診断法に使用されます。 41.鉄化合物の生物学的役割。 ヘモグロビン 鉄は動物や植物の組織に見られる生体要素です。 成人の体内の鉄の総量は約 5 g で、0,007% です。 金属鉄は毒性が低く、Fe (II)、Fe (III) および Fe (VI) 化合物が大量に存在すると健康に有害です。 ミオグロビン、シトクロム、カタラーゼは細胞呼吸を提供します。 これらすべてのタンパク質は、実際のタンパク質部分とそれらに関連する活性中心で構成されています。 活性中心は大環状複合化合物であるヘムです。 化合物ポルフィリンは大環状リガンドとして機能します。 ドナー窒素原子は正方形の角に位置し、その中心に Fe イオンが位置します。 一般に、錯体は八面体構造をとります。 アミノ酸窒素 (ヒスチジン) を通る XNUMX 番目の軌道は、ヘムをタンパク質に結合するために使用されます。 ヘモグロビンは、単一の高分子凝集体を形成する4つのタンパク質分子(サブユニット)で構成されています。 各サブユニットは、ミオグロビン分子と構造が似ています。 したがって、ヘモグロビンは同時にXNUMX分子のOに結合できます2 、ミオグロビン - 1。 組織内には非ヘム鉄を含むタンパク質複合体もいくつか存在します。 これらは、例えば、酵素、オキシダーゼ、ならびに貯蔵タンパク質(デポー)および鉄輸送体である。 過剰な鉄は、タンパク質トランスフェリンによって血液中に輸送され、さまざまな組織や器官、特に肝臓、脾臓、骨髄にタンパク質フェリチンの形で蓄積されます。 フェリチンは、直径24〜12 nmの球を形成する14個のタンパク質分子(サブユニット)で構成されています。 各サブユニットには、最大7個の鉄原子を含む直径4500nmの空洞が含まれています。 したがって、各フェリチン骨材は約100個の鉄原子を貯蔵でき、この元素が関与する多数の代謝反応を提供します。 化学平衡の法則に基づいて、肺から組織への酸素運搬体としてのヘモグロビンの機能を理解することは難しくありません。 酸素を含まないヘモグロビン(デオキシヘモグロビン)は弱酸で、その化学式はHHbで表すことができます+。 酸素の添加はプロトンの除去を伴い、オキシヘモグロビンHbOが形成されます。2 . この場合、平衡があります。 HHb+ + O2 →HbO2 + N+. 酸素分圧が高い (最大 20 kPa) 酸素の少ない静脈血が肺に入ると、ヘンリーの法則に従ってその溶解度が増加します。 これは、ル シャトリエの原理に従って、右への平衡のシフトとオキシヘモグロビンの形成につながります。 右への平衡の追加のシフトは、肺で pH 値が増加する (7,5 まで) という事実によるものです。 その結果、肺では、デオキシヘモグロビンは酸素でほぼ完全に (最大 97%) 飽和し、オキシヘモグロビンに移行します。 末梢組織を貫通する毛細血管では、酸素分圧は 5 kPa に低下し、pH 値は 7,2 に低下します。 その結果、平衡は左にシフトします。 末梢から流れる血液では、ヘモグロビンは酸素で65%しか飽和していません。 42.鉄化合物の生物学的役割。 CO一酸化炭素。 ヘム含有タンパク質の金属錯体特性は、CO (一酸化炭素) や MCN (シアン化物 - 青酸の塩) などの有毒物質の影響下で現れます。 生理学的観点から最も重要なのは、ヘモグロビン、ミオグロビン、シトクロム、ペルオキシダーゼ、カタラーゼなどの鉄含有タンパク質です。 ヘモグロビンは赤血球の主成分であり、外部呼吸を提供し、肺から組織へ酸素を運ぶ役割を果たします。 鉄 Fe とコバルト Co は、生物の必須微量元素です。 一酸化炭素 CO は、燃料の不完全燃焼の生成物の XNUMX つです。 このガスは、ボイラー、内燃機関、および喫煙の運転中に大量に排出されます。 酸素ヘモグロビン HbO と並行して、CO が肺の空気と一緒に吸入されると2 金属錯体化合物、カルボニルヘモグロビンHbCOが形成されます。 HbCO の安定定数は HbO の約 200 倍です2 。 したがって、たとえ少量の CO であっても、かなりの割合のデオキシヘモグロビンが「遮断」され、その結果、臓器への酸素の供給が減少します。 低酸素症、つまり酸素欠乏症の兆候が現れます。 神経組織が最初に影響を受けます。 一酸化炭素を解毒する(毒性を取り除く)には、多くの場合、一酸化炭素の供給を止めて酸素換気を増やすだけで十分です。つまり、被害者を新鮮な空気の中に連れていきます。 この場合、ル シャトリエの原理が再び機能します。平衡状態はオキシヘモグロビンの形成に向けて移行します。 高濃度では、一酸化炭素は細胞呼吸のヘム含有タンパク質をブロックし、致死的な結果を回避することは困難です。 シアン化物の作用機序は似ていますが、その毒性はCOよりも高くなっています。 これらの物質がごく少量でも血中に入ると、呼吸停止と死に至ります。 シアン化物の高い毒性は、シアン化物ヘモグロビンのより大きな安定性を決定するFe-CN-結合の高い強度によって説明されます。 酸素呼吸は過酸化水素Hの形成につながります2O2 。 この物質は高い酸化力を持っています。 細胞の生体有機化合物と相互作用すると、不飽和原子価を持つ非常に活性な分子粒子であるラジカルが形成され、過酸化物の酸化が始まります。 ラジカルの影響下で、細胞の最も重要な構成要素である膜と DNA が破壊されます。 生物学の進化の過程で、自然は過酸化水素を破壊する特別なタンパク質であるカタラーゼ酵素を開発しました。 これにより、この物質の過剰な蓄積が制限され、細胞の破壊が防止されます。 カタラーゼ(CatFe2+ ) は、XNUMX つの連続する反応の触媒サイクルとして表すことができます。 カフェ2+ + N2O2 - 猫フェ2+ × H2O2 , カフェ2+ × H2O2 + N2O2 → キャットフェ2+ +2Н2O2 + O2 . その結果、2 つの過酸化水素分子が破壊され、CatFe2+ 生体触媒分子が放出され、次の触媒サイクルに入ることができます。 このプロセスは非常に高速です。 1 秒以内に、20 つのカタラーゼ分子は最大 000 サイクルを実行できます。 43. 鉄およびコバルト化合物の生物学的役割 体内の鉄分が不足すると、病気が発症する可能性があります-鉄欠乏性貧血(貧血)。 ヘモグロビンの合成のための鉄の不足に関連する組織の酸素欠乏があります。 その結果、末梢器官への酸素供給が減少し、それに応じて細胞呼吸のレベルが低下し、代謝が遅くなります。 薬物として塩化鉄(II)または硫酸鉄(II)を導入すると、病気の重症度が軽減されます。 同じ目的で、胃液の塩酸に溶けやすい金属鉄の微粉末(還元鉄、1回あたり最大XNUMXg)を使用します。 したがって、この薬の作用は塩化鉄(II)の作用と似ています。 ただし、鉄と糖、ニコチンアミド、その他の有機物質との生物無機複合体である薬の方が効果的です。 そのような複合体は血液によく吸収され、それがそれらの薬理学的有効性の理由です。 興味深いのは、古代から現代に至るまで、いわゆる鉄ワイン、つまり鉄粉にブドウ酒を浸して作った飲み物が、鉄欠乏性貧血の治療に使用されてきたことです。 明らかに、鉄はワイン(酸性媒体)に溶解し、ワインに大量に含まれる天然有機物質と複合体を形成します。 古代の飲み物の作用機序が現代の薬の作用機序とほぼ同じであることは明らかです。 鉄と同様に、コバルトも最も重要な生体要素の 1,2 つです。 成人の体内のコバルトの総量は約 10 mg で、100% 未満です。 この塊の約 XNUMX mg は、シアノコバラミン (脂溶性ビタミン B12 )およびその類似体。 この物質は、ヘムと同様に大環状複合化合物です。 四座化合物であるポルフィンは、大環状配位子として機能します。 R は複雑な有機置換基です。 シアノコバラミンの類似体では、さまざまな有機置換基が CN アニオンの代わりに作用します。 ビタミンBの最も重要な役割12 赤血球の発生と形成(赤血球生成)に関与しています。 ビタミンB欠乏症12 (3日あたりの摂取量がXNUMXμg未満)は、重篤な病気、悪性貧血(貧血)を引き起こします。 シアノコバラミンの類似体は、赤血球形成に関与するさまざまな酵素の補因子である活性化因子であることが確立されています。 補因子の欠如は、ヘモグロビンと赤血球の欠乏に現れます。 植物や動物はビタミンBを合成できない12. 特定の種類の細菌によってのみ生成されます。 これらの細菌は、人間の消化管に存在します。 彼らは十分なビタミンBを合成します12. 悪性貧血は、このビタミンの血中への吸収障害と関連しています。 したがって、錠剤を服用しても効果がありません。 ビタミン(100〜200 mcgを2日間)を血液に注射すると、悪性貧血の患者の状態が大幅に改善されます。 44.IBグループのd要素の役割。 医学におけるそれらの化合物の使用 銅 Cu は生物にとって必須の微量元素です。 銀 Ag および金 Au は微量元素です。 それらの化合物は医学に使用されています。 銅は、動物や植物の組織に含まれる生体元素です。 成人の体内の銅の総質量は約 100 mg、つまり約 0,0001% です。 この量の約 30% は筋肉に含まれています。 肝臓と脳にも銅が豊富に含まれています。 金属銅とその化合物は有毒です。 生理学的観点から最も重要なのは、銅含有タンパク質であるシトクロムオキシダーゼとスーパーオキシドジスムターゼです。 シトクロムオキシダーゼは、ミトコンドリア膜に局在する呼吸鎖の構成要素の XNUMX つです。 呼吸鎖の末端で酸素を水に還元することにより、細胞呼吸を提供します。 体は毎日 2,5 ~ 5,0 mg の銅を必要とします。 体内の銅が不足すると、銅欠乏性貧血という病気が発症する可能性があります。 銅は鉄の吸収、特に鉄と銅の両方を含むシトクロムオキシダーゼの合成に必要です。 銅が欠乏すると、結合組織や血管の正常な発達が妨げられます。 中毒は通常、偶発的な殺虫剤の過剰摂取、金属粉末の吸入、銅塩溶液の摂取に関連しています。 壁に保護コーティングを施していない銅製の容器に保管された飲み物は非常に危険です。 外用剤として、硫酸銅 CuSO の 0,25% 水溶液を使用します。4 粘膜の炎症および結膜炎を伴う。 この薬の少量は、貧血の赤血球生成を増加させるために食物と一緒に服用することができます. シルバーとゴールド 成人の体内には、約 1 mg の銀、つまり約 10% (1 ppm)、最大 10 mg の金、つまり約 10% (10 ppm) が含まれています。 可溶性銀塩の防腐特性は、古くから知られています。 聖職者は、銀の容器に保管された水(「聖なる」)が長期間劣化しないこと、つまり微生物汚染を受けないことを長い間知っていました。 現在、この「銀」水の特性は、長距離航海の船員によって使用されています。 7gのAgNOを摂取すると、成人で強い中毒症状が観察されます。3. 医学では、結晶性硝酸銀AgNO03(ラピス)やその水溶液などの薬物が長い間使用されてきました。 コロイド状金属銀製剤であるプロタルゴール (8% Ag) とカラーゴール (70% Ag) は古くから知られており、金属光沢のある微粉末です。 そのような粉末の各粒子は、アルブミン(プロタルゴール)またはコラーゲン(コラーゲン)のタンパク質コートを有する、サイズが1μm未満の還元された金属銀の結晶である。 タンパク質の殻は、銀の結晶がくっつくのを防ぎ、水性媒体への移行 (可溶化) を確実にします。 銀製剤は、抗炎症剤、防腐剤、収斂剤として使用されます。 金製剤は、効果的な抗炎症薬としても使用されます。 最もよく知られているのは、貴金属を30%含むクリザノールとコロイド金です。 45.グループIIBのd要素の生物学的役割。 医学におけるそれらの化合物の使用 亜鉛 Zn、カドミウム Cd、水銀 Hg は微量元素です。 成人の体には、1,8 g の Zn、50 mg の Cd、13 mg の Hg が含まれています。 カドミウムと水銀は不純物元素です。 水銀の約 70% は脂肪と筋肉組織に集中しています。 カドミウムは腎臓に 30% 局在し、残りは肝臓、肺、膵臓に局在しています。 亜鉛は、すべての動植物にとって不可欠な元素です。 成人の体内では、ほとんどの亜鉛が筋肉 (65%) と骨 (20%) に含まれています。 残りの量は、血漿、肝臓、赤血球に落ちます。 前立腺における亜鉛の最高濃度。 亜鉛は可変原子価を示さない。 したがって、明らかに、その生体複合体は、電子伝達なしで起こる加水分解の多くの生化学反応に参加しています。 Zn イオンは、エステルとタンパク質の加水分解を触媒する 40 以上の金属酵素の一部です。 最も研究されているものの30つは、亜鉛の生物無機複合体であり、約000個のアミノ酸残基からなる酵素炭酸脱水酵素(Mg = 260)です。 亜鉛は、ジペプチド(2つのアミノ酸からなる物質)の加水分解を触媒する酵素であるジペプチダーゼには含まれていません。 亜鉛は、血糖を調節するホルモンであるインスリンと生体無機複合体を形成します。 人間の亜鉛の必要性は、肉、乳製品、卵などの食品によって完全に満たされます。 植物の亜鉛が不足すると、タンパク質と炭水化物の代謝が妨げられ、クロロフィルとビタミンの合成が阻害されます。 亜鉛欠乏症は亜鉛含有肥料を使用することで解消されます。 IIB 族化合物の毒性は、亜鉛から水銀に向かって増加します。 水溶性化合物は皮膚を刺激し、摂取すると中毒を引き起こします。 金属自体も有毒です。亜鉛蒸気(亜鉛製造からの空気)を吸入すると、「金属」熱が現れます。 中世の水銀蒸気中毒は「マッドハッター病」と呼ばれていました。 食品(日本のような海産物)中の水銀濃度は水俣病を引き起こします。 水銀の毒性は、赤血球の凝集(くっつき)と酵素阻害に関連しています。 たとえば、昇華物はサイズの変化、浸透圧の脆弱性、および毛細管を通る赤血球の移動に必要な変形能の低下を引き起こします。 カドミウムの毒性は、核酸に対するカドミウムの親和性に関連しています。 DNA に結合すると、その機能が破壊されます。 慢性的なカドミウムと水銀の毒性は、骨の石灰化を損なう可能性があります。 有毒な要素はカルシウムを置き換えることができます。 これは、骨組織の結晶成分のパラメーターの歪みにより、不完全な構造のアパタイトの形成につながります。 その結果、骨の強度が低下します。 46. グループIIB(Zn、Cd、Hg)の化合物の毒性 化合物Zn、Cd、Hgはタンパク質代謝の違反を引き起こす可能性があり、これは腎臓を介した血漿タンパク質の放出(タンパク尿)に現れます。 グループ IIB 化合物の身体への毒性効果は、これらの金属イオンがタンパク質、酵素、およびアミノ酸のスルフヒドリル SH グループと相互作用するという事実によっても引き起こされます。 金属イオンが SH 基と相互作用すると、弱く解離し、通常は不溶性の化合物が形成されます。 したがって、スルフヒドリル基をブロックすると、酵素活性とタンパク質のフォールディングが抑制されます。 二価金属イオンは XNUMX つの SH 基を同時にブロックします。 このタイプの反応では、金属イオンがアクセプターとして機能し、硫黄が電子供与体として機能します。 水銀中の SH 基に対する最も顕著な化学的親和性。 明らかに、これは水銀の錯化特性が高く、硫黄とのより強い結合を形成するという事実によるものです。 SHグループは100以上の酵素の一部であり、これらのグループのブロックによりその活性を抑制することができます。 したがって、金属で体を中毒させるための遮断のメカニズムと治療法を知ることがいかに重要であるかは明らかです。 元素の毒性は、体内に入る化学形態に依存することが知られています。 最も毒性の高い形態は、脂質に溶解し、膜を通って細胞に容易に浸透する形態です。 文献には、日本における集団水銀中毒の事例が記載されています。 微生物の酵素の作用下にある水銀の無機化合物は、メチル水銀に変換されました。 メチル水銀は魚に蓄積され、食物とともに人体に入りました。 徐々に濃縮するメチル水銀は、体内で不可逆的な破壊と死を引き起こします。 医学における亜鉛および水銀化合物の使用は、それらの収斂性、焼灼および消毒効果に基づいています。 点眼薬として、硫酸亜鉛ZnSOの0,25%水溶液が使用されます。4. 歯科では、炎症を起こした粘膜を治療するために、乳頭腫を焼灼するために塩化亜鉛が使用されます. 酸化亜鉛 ZnO も使用されます。 塩化水銀 (II) (塩化第二水銀) は非常に毒性が高く、高希釈 (1: 1000) の水溶液が消毒に使用されます。 皮膚および性感染症の治療には、酸化水銀(II)HgOおよび硫化水銀(II)HgSを含む軟膏が使用されます。 塩化水銀(I) (カロメル) は水に溶けにくいため、わずかに毒性があります。 この塩は獣医学で下剤として使用されます。 通常の状態における水銀は、他の金属を溶解することができる液体金属です。 この場合、硬質合金、つまりアマルガムが形成されます。 歯科では、銀とカドミウムのアマルガムが歯を埋めるために長い間使用されてきました。 化学的に不活性で、加熱すると容易に軟化するため、成形が容易です。 紫外線光源 - 医療用水銀石英ランプ - にはガス状水銀 (蒸気) が含まれています。 病院の敷地内でこのランプの光を照射すると、空気中に含まれる微生物が死滅します。 さまざまな皮膚疾患は紫外線の助けを借りて治療されます。 したがって、機能の性質と身体への影響に応じて、IIB グループの金属は、重要な元素である Zn と、有毒な不純物元素である Cd および Hg に分けることができます。 47. グループ IIIA の p 元素の生物学的役割。 医学におけるそれらの化合物の使用 ホウ素は不純物微量元素であり、人体におけるその質量分率は 105% です。 ホウ素は、主に肺 (0,34 mg)、甲状腺 (0,30 mg)、脾臓 (0,26 mg)、肝臓、脳 (0,22 mg)、腎臓、心筋 (0,21 mg) に集中しています。 ホウ素の生物学的効果はまだ十分に研究されていません。 ホウ素は歯や骨に存在することが知られており、金属カチオンとホウ酸の難溶性塩の形で存在するようです。 過剰なホウ素は人体に有害です。 過剰なホウ素がアミラーゼ、プロテイナーゼを阻害し、アドレナリンの活性を低下させるという証拠があります。 人体の含有量 (105%) によると、アルミニウムは不純物微量元素に属します。 アルミニウムは主に血清、肺、肝臓、骨、腎臓、爪、髪に集中しており、人間の脳の神経鞘の構造に入ります。 人間の一日のアルミニウム摂取量は 47 mg です。 アルミニウムは、上皮および結合組織の発達、骨組織の再生に影響を与え、リンの交換に影響を与えます。 アルミニウムは酵素プロセスに影響を与えます。 体内の過剰なアルミニウムは、ヘモグロビンの合成を阻害します。これは、そのかなり高い複合体形成能力のために、アルミニウムが造血に関与する酵素の活性中心をブロックするためです。 アルミニウムがアミノ基転移反応を触媒できるという証拠があります。 ガリウムは不純物微量元素です(人体の含有量は10-6-10-5%)。 生物におけるガリウムの生物学的役割は、ほとんど明らかになっていません。 タリウムは毒性の強い元素です。 T1 イオンは、Ag+ と同様に、硫黄含有配位子と強い化合物を形成する傾向があります。 その結果、チオ基(SH)を含む酵素の活性を阻害するため、非常に有毒です。 たとえ非常に少量の T1+ 化合物を摂取したとしても、脱毛の原因となります。 半径Kが近接しているため+ およびT1+ それらは同様の特性を持ち、酵素で互いに置き換えることができます. イオン T1 と K は相乗剤です。 これは、ピルビン酸キナーゼとジオールデヒドラターゼという酵素が、K イオンだけでなく、T1 イオンによっても活性化されるという事実を説明しています (T1 イオンは、酵素の触媒中心で K イオンに置き換わります)。 タリウムとカリウムの相乗作用は、K イオンと同様に、T1 イオンが赤血球に蓄積するという事実にも表れています。 T1 イオン中毒の解毒剤として、硫黄含有リガンドであるアミノ酸シスチンが使用されます。 結論として、グループ IIIA の p 元素の生物学的役割は十分に研究されていないことに注意する必要があります。 ホウ素とガリウムは植物内でポリフェノールと相互作用し、それらの発生を阻害し、後者の毒性を軽減することが現在知られています。 上皮および結合組織の構築におけるアルミニウムの疑いのない役割、さらに、活性化剤および阻害剤としての酵素プロセスへの関与も確立されています。 T1 イオンには、多くの硫黄含有酵素を阻害する能力があります。 グループ IIIA 元素の生物学的活性は、主に、酸素含有配位子および不溶性リン酸塩と複合化合物を形成する能力に関連しています。 48. IVAグループのp要素の生物学的役割。 医学におけるそれらの化合物の使用 人体の含有量 (21,15%) によると、炭素は多量栄養素に属します。 それは、タンパク質、脂肪、炭水化物、ビタミン、ホルモンの形ですべての組織と細胞の一部です. 生物学的な観点からは、炭素は第 1 の器官原です。 人体の含有量 (103% ι) によると、シリコンは不純物微量元素に属します。 肝臓、副腎、髪、レンズのほとんどのシリコン。 天然の二酸化ケイ素は水に溶けにくいため、消化管からではなく、ほこりの多いSiO の形で肺から空気によって人体に入ります。2. シリコン代謝の違反により、高血圧、リウマチ、潰瘍、貧血の発生が関連しています。 医療行為では、炭化ケイ素 (IV) SiC が使用されます - 詰め物やプラスチック補綴物を研削するためのカーボランダムです。 二酸化ケイ素SiO2 ケイ酸塩セメントの一部。 石炭、二酸化ケイ素、アルミニウムの粒子からなる粉塵が肺に体系的に曝露されると、じん肺という病気を引き起こすことに注意する必要があります。 石炭の粉塵にさらされると炭疽病となり、鉱山労働者の職業病となります。 S1Oを含む粉塵を吸入した場合2 、珪肺症が発生し、アルミニウムの粉塵にさらされるとアルミノーシスが発生します。 人体の内容によると(10-6-10-5%) ゲルマニウムは微量元素です。 生物学的役割は完全には解明されていません。 ゲルマニウム化合物は、骨髄における造血のプロセスを強化します。 また、ゲルマニウム化合物は毒性が低いことも知られています。 人体の内容によると(104 %) スズは微量元素を指します。 スズは、スズの層でコーティングされたブリキ缶に保存された酸性食品とともに人体に入ります。 酸性環境では、スズは溶解して塩の形で血中に入り、毒性作用を示します。 しかし、ラットでの実験では、少量のスズがラットの成長を刺激する効果があることがわかりました。 これは、人間にとって必要であると仮定する理由を与えます。 間違いなく、この微量元素の生物学的役割の解明にはさらなる研究が必要です. 医療行為では、さまざまな材料、特にスズを含む充填材料が使用されます。 そのため、スズはフィリングの製造用の銀アマルガム (28%) の一部です。 鉛とその化合物、特に有機化合物は非常に有毒です。 リード化合物は、タンパク質合成、細胞およびその遺伝装置のエネルギーバランスに影響を与えます。 多くの要因が変性メカニズムに有利に働きます。 鉛は、食品中の存在が虫歯の進行に影響を与える元素の XNUMX つであることが確立されています。 食物、水、大気により、人は毎日最大 100 mcg の鉛を吸収します。 鉛は主に骨格内に難溶性リン酸塩の形で(最大 90%)沈着します。 人間の体内の鉛の質量分率は 106% です。 鉛の 0,2 日摂取量は 2 ~ XNUMX mg であり、人間にとって安全であると考えられています。 医療行為では、酢酸鉛 (ローション) と酸化鉛 (II) PbO (単純な鉛パッチの一部) は、外部の収斂性の防腐剤として使用されています。 49. VA グループの p 要素の生物学的役割。 それらの化合物の医薬品への使用(窒素、リン) 人体の窒素含有量(3,1%)は多量元素に属します。 体の乾物(水を含まない)の質量のみを考慮すると、細胞内の窒素含有量は8〜10%になります。 この要素は、アミノ酸、タンパク質、ビタミン、ホルモンの構成要素です。 窒素は、生体分子内の水素および炭素原子と極性結合を形成します。 多くの生体無機複合体 (金属酵素) では、窒素原子がドナー - アクセプター機構を通じて分子の無機部分と有機部分に結合します。 窒素は酸素と炭素とともに重要な化合物、つまり塩基性の性質を持つアミノ基と酸性の性質を持つカルボキシル基(-COOH)を同時に含むアミノ酸を形成します。 アミノ基は核酸分子においても非常に重要な機能を果たします。 窒素含有バイオリガンド、たとえばヘモグロビンなどのポルフィリンの生理学的重要性は非常に重要です。 窒素循環は生物圏で行われます。 窒素循環は農業に不可欠です。 窒素のもうXNUMXつの生物学的に重要な特性に注意する必要があります-水への溶解度は酸素の溶解度とほぼ同じです。 血液中の過剰な窒素の存在は、減圧症の発症の原因となる可能性があります。 ダイバーの急速な上昇に伴い、圧力が急激に低下し、それに応じて血液中の窒素の溶解度が低下し(ヘンリーの法則)、血液から出る窒素元素の泡が小さな血管を詰まらせ、麻痺や死に至る可能性があります. 人体内のリンの含有量 (0,95%) によれば、リンは主要栄養素として分類されます。 リンは器官元素であり、代謝において非常に重要な役割を果たします。 リン酸塩の形のリンは、細胞内 ATP の必須成分です。 これは、タンパク質 (0,5 ~ 0,6%)、核酸、ヌクレオチド、およびその他の生物学的に活性な化合物の一部です。 リンは、動物や人間の骨格(オルトリン酸カルシウム、ヒドロキシアパタイト)、歯(ヒドロキシアパタイト、フルオロアパタイト)の基礎です。 多くの生合成反応は、高エネルギー受容体から低エネルギー受容体へのリン酸基の移動により行われます。 リン酸緩衝系は、血液中の主要な緩衝系の XNUMX つです。 生物はリンなしでは生きられません。 リンの重要性は、事前のリン酸化なしでは細胞が糖と脂肪酸をエネルギー源として使用できないという事実にあります。 体内のリンの交換は、カルシウムの交換と密接に関係しています。 これは、血液中のカルシウム含有量の増加に伴う無機リンの量の減少(拮抗作用)によって確認されます。 人間の 1,3 日あたりのリン必要量は XNUMX g ですが、リンは食品に広く含まれているため、明らかな欠乏症 (リン酸欠乏) のケースはほとんど知られていません。 しかし、食品に含まれるすべてのリンが吸収できるわけではありません。その吸収は、pH、食品中のカルシウムとリン含有量の比、食品中の脂肪酸の存在など、多くの要因に依存しますが、主にビタミン D 含有量に依存します。 多くのリン化合物が医薬品として使用されています。 C-P 結合を含む有機リン化合物は強力な神経毒であり、化学兵器の一部であることに注意する必要があります。 50. VA グループの p 元素 (ヒ素、アンチモン、ビスマス) の生物学的役割。 医学におけるそれらの使用 人体の内容によると、ヒ素は微量元素に属します。 肝臓、腎臓、脾臓、肺、骨、髪に集中します。 ほとんどのヒ素は、脳組織と筋肉に見られます。 ヒ素は骨や髪に蓄積し、数年間完全に除去されません。 この機能は、法医学検査でヒ素化合物による中毒があったかどうかの問題を明確にするために使用されます。 生物学的物質中のヒ素の測定は、マーシュ反応による単純な装置で行われます。生物学的対象物に亜鉛と塩酸が加えられます。 反応中に放出された水素は、ヒ素化合物をアルシンに還元します。 放出された水素にアルシンの混合物が含まれている場合、ガス混合物が加熱されると AsH が分解します。3 : 2アッシュ3 = 2As° + 3H2. そして、ガス放出管の壁にはヒ素の黒い光沢のあるコーティングが形成されます - 「ヒ素ミラー」。 マーシュ反応は非常に敏感であり、7 ~ 10 を検出できます。7 gヒ素。 比較的大量のヒ素化合物は非常に有毒です。 すでに述べたように、ヒ素化合物の毒性効果は、酵素やその他の生物活性物質のスルフヒドリル基をブロックすることによるものです。 人体内の含有量(10%)によると、アンチモンとビスマスは微量元素とみなされます。 V.V. Kovalsky の分類によれば、アンチモンとビスマスは、生物体内に常に存在する微量元素のグループのメンバーとして分類されていますが、その生理学的および生化学的役割は実際には不明です。 アンチモンの生理的役割は明らかにヒ素と似ています。 ヒ素 As とアンチモン Sb のイオン、および程度は低いがビスマス Bi は相乗効果を発揮します。 したがって、生物にヒ素が過剰に含まれる生物地球化学的領域では、ヒ素だけでなくアンチモンの含有量も増加することが知られています。 同時に、両方の要素が住民の甲状腺に蓄積し、その機能を阻害し、固有の甲状腺腫を引き起こします。 ヒ素とアンチモンの相乗作用は、硫黄含有配位子と化合物を形成する能力に関連しています。 ビスマスは、アミノ基を含む配位子と結合する傾向があります。 したがって、体内への可溶性ビスマス化合物の侵入は、酵素アミノおよびカルボキシポリペプチダーゼの阻害につながります. スチビン SbH3 などの水溶性アンチモン化合物を摂取すると、ヒ素化合物と同様の毒性効果があります。 ビスマス化合物も注射すると有毒です。 たとえば、犬の場合、致死量は 6 mg/kg 体重です。 ただし、ほとんどのアンチモンとビスマス化合物が消化管に入ると、実際には毒性の影響はありません。 これらの化合物の弱い毒性は、消化管内のSb(III)、Bi(III)塩が加水分解を受け、消化管の壁に吸収されない難溶性の生成物が形成されるという事実によるものです。 これは、塩基性硝酸ビスマスなどのアンチモンとビスマスの薬物の使用の基礎です。 51. VIAグループのp要素の生物学的役割。 医学におけるそれらの化合物の使用 人体の含有量 (62%) によると、酸素は多量栄養素に属します。 それは不可欠であり、生命システムの基礎を形成する最も重要な要素のXNUMXつ、つまりオルガノゲンです。 酸素は、最も単純なものから生体高分子まで、膨大な数の分子の一部です。 酸素による栄養素(炭水化物、タンパク質、脂肪)の酸化は、生物の器官や組織の機能に必要なエネルギー源として機能するため、生命プロセスにおける酸素の役割は素晴らしいです。 体内のほとんどの酸化還元反応は、酸素とその活性型の関与によって進行します。 体の貪食(保護)機能も酸素の存在に関連しており、体内の酸素含有量の減少はその保護特性を低下させます。 貪食細胞 (異物を捕捉して消化できる細胞) では、酸素 O02 がスーパーオキシドに還元されます。 医療行為では、酸素欠乏症(低酸素症)、気道の疾患、心血管系の疾患、一酸化炭素(II)COによる中毒、シアン化水素酸HCN、および呼吸機能障害のある疾患を伴う痛みを伴う状態での吸入に酸素が使用されます. 臨床現場で広く使用されているのは、高圧下での酸素の使用である高圧酸素化です。 酸素の同素体修飾-非常に強力な酸化剤としてのオゾンO3は、施設の消毒、空気の消毒、および飲料水の浄化に使用されます。 人体内の含有量 (0,16%) に関して、硫黄は主要栄養素として分類されます。 酸素と同じように、それは不可欠です。 成人の4日の硫黄必要量は約5〜1gで、硫黄はタンパク質、アミノ酸(シスチン、システイン、メチオニンなど)、ホルモン(インスリン)、ビタミン(ビタミンBXNUMX)など、多くの生体分子の一部です。 硫黄は髪の毛や骨、神経組織のカロテンに多く含まれています。 生体内では、アミノ酸の一部である硫黄が酸化されています。 このプロセスの最終生成物は主に硫酸塩です。 さらに、チオ硫酸塩、セメント硫黄およびポリチオン酸が形成される。 本文の内容によると(10-5-10-7%) セレンは微量元素です。 一部の研究者は、それが重要な要素であると考えています。 セレンは食物から得られます - 年間55-110 mg。 セレンは主に肝臓と腎臓に集中しています。 血中のセレン濃度は0,001~0,004mmol/lです。 生物におけるセレンと硫黄との関係は疑いの余地がありません。 高用量では、セレンは主に爪や髪に蓄積しますが、これらは硫黄含有アミノ酸に基づいています. 水銀HgとカドミウムCdによる中毒から体を保護するセレンの能力も知られています. セレンは、これらの有毒金属の他の活性中心、つまり毒性効果の影響を受けない活性中心への結合を促進します。 興味深い事実は、食事中のセレンの含有量が高いことと、がんによる死亡率が低いこととの関係です. セレンは高用量では有毒です。 動物のセレン化合物の分解は、ニンニク臭のある非常に有毒なジメチルセレンの放出につながります. 52. グループVIIAのp元素の生物学的役割。 それらの化合物の医薬品への使用(フッ素および塩素) 人体内の含有量に関しては、塩素 (0,15%) は多量元素に属しますが、このグループの残りの元素は微量元素 (含有量 - 10) です。5 %)。 さまざまな化合物の形のハロゲンは、人間や動物の組織の一部です。 塩素とヨウ素はかけがえのない要素ですが、残りは組織の恒久的な構成要素です。 人体のフッ素の質量は約 7 mg (~105 %)。 フッ素化合物は、骨組織、爪、歯に集中しています。 歯の組成には約 0,01% のフッ素が含まれており、そのほとんどはエナメル質に付着しています。 体内にフッ素が不足すると虫歯になります。 フッ素は虫歯から歯を保護するため、フッ素の生物学的作用への関心は、主に歯科疾患の問題に関連しています。 歯組織(象牙質)のミネラルベースは、ヒドロキシアパタイト、クロアパタイト、フルオロアパタイトです。 非常に多くの場合、エナメル質の層で覆われた歯の外面ではなく、エナメル質が損傷したときに露出した象牙質の内部が破壊されます。 エナメル質がわずかに損傷している間、フッ化ナトリウムの導入がフッ素アパタイトの形成を促進し、始まった損傷の再石灰化を促進するという提案があります. フッ化ナトリウム NaF は、局所外用剤として医療行為で使用されます。 NaF の使用は、フルオロアパタイトの形成に基づいています。 同時に、口腔環境のアルカリ化も起こり、細菌によって生成された酸の中和に寄与します. フッ化物は欠乏するだけでなく、過剰になると有害です。 飲料水中のフッ化物含有量が最大許容基準(1,2 mg/l)よりも高い場合、歯のエナメル質がもろくなり、簡単に破壊され、骨の脆弱化、骨の変形、全身の疲労といった慢性フッ化物中毒の他の症状が現れます。 。 この場合に起こる病気はフッ素症(フッ素症)と呼ばれます。 人体には約 100 g (2790 mmol) の塩素が含まれています。 クロリディオンは重要な生物学的役割を果たします。 それらは、いくつかの酵素を活性化し、胃液のタンパク質分解酵素の作用に好ましい環境を作り出し、細胞膜を通るイオンの流れを提供し、浸透バランスの維持に関与します. クロリジオンは、細胞膜を通過するのに最適な半径を持っています。 これは、特定の浸透圧の作成と水 - 塩代謝の調節における Na および K イオンとの共同参加を説明しています。 塩化ナトリウムの5日の必要量は10〜XNUMX gで、すでに説明したように、胃での塩酸の生成にはNaClが必要です。 消化過程における塩酸の重要な役割に加えて、それはさまざまな病原菌(コレラ、腸チフス)を破壊します。 バクテリアが大量の水で胃に入ると、HClの希釈により抗菌効果がなくなり、バクテリアは生き残ります。 これが体の不調につながります。 したがって、流行の間、原水は特に危険です。 胃の中の塩酸が不足すると、pHが上昇し、正常な消化が妨げられ、人間の健康に深刻な影響を与えます. 胃液の酸性度を下げると、塩酸の希薄溶液が医療行為に使用されます。 胃の炎症(胃炎)、消化性潰瘍、胃液の分泌が増加し、その酸性度が増加します。 53. グループVIIAのp元素の生物学的役割。 医薬品におけるそれらの化合物の使用(臭素、ヨウ素) 人体の臭素の質量は約 7 mg です。 それは主に内分泌腺、主に下垂体に局在しています。 体の正常な機能における臭素化合物の生物学的役割は、まだ十分に解明されていません。 臭素化合物は甲状腺の機能を阻害し、副腎皮質の活動を高めます。 臭素イオンが体内に導入されると、中枢神経系が最も敏感になります。 ブロミディオンは脳のさまざまな部分に均等に蓄積し、興奮性を高めて落ち着かせます。 それらは、興奮と抑制のプロセス間の乱れたバランスの回復に貢献します。 臭素イオンは消化管で容易に吸収されます。 臭化物イオンの毒性は低いです。 体からの排泄が遅いため(30〜60日以内)、蓄積(蓄積)する可能性があり、ブロミズムと呼ばれる慢性中毒の発症につながります。 慢性臭素中毒の徴候が現れた場合は、臭化物製剤を直ちに中止する必要があります。 さらに、臭素イオンの放出速度を高めるために大量の塩化ナトリウム(25日あたり最大0,05 g)が投与され(ルシャトリエの原理)、豊富な飲み物が処方されます。 個々の感受性が異なるため、臭素製剤の投与量は 2,0 から XNUMX g までさまざまです。 ヨウ素は必須栄養素の 25 つであり、その化合物は代謝プロセスにおいて重要な役割を果たします。 ヨウ素は、特定のタンパク質、脂肪、ホルモンの合成に影響を与えます。 人間の体には約1mgのヨウ素が含まれています。 体内のヨウ素総量のうち、半分以上が甲状腺に存在します。 この腺に含まれるほとんどすべてのヨウ素は結合状態 (ホルモンの形) にあり、ヨージジオンの形はそのうちの約 25% のみです。 甲状腺は、血漿中の含量と比較して I-XNUMX 倍濃縮することができます。 甲状腺は、チロキシンとトリヨードチロニンというホルモンを分泌します。 甲状腺機能低下症 (甲状腺機能低下症) は、ヨウ化物イオンを蓄積する能力の低下や、食事中のヨウ素不足 (風土病性甲状腺腫) と関連している可能性があります。 風土病性甲状腺腫では、ヨウ素製剤が処方されます:(ヨウ化カリウムKIまたはヨウ化ナトリウムNaI)ヨウ素に対する人間の毎日の必要量(0,001 gのヨウ化カリウム)に対応する用量。 ヨウ素が欠乏している地域では、風土病の甲状腺腫を防ぐために NaI または K が食卓塩に加えられます! (1kgあたり2,5~100g)。 甲状腺ホルモンの過剰な合成による甲状腺の活動の増加(甲状腺機能亢進症)に伴い、代謝プロセスの異常な増加率が観察されます。 甲状腺機能亢進症の治療にこれらの薬が無効であるため、放射性ヨウ素 131 Iの製剤が使用され、その放射線は甲状腺の卵胞を破壊し、それによってホルモンの過剰な合成を減らします。 グループVIIAのすべての要素は生理学的に活性であり、塩素とヨウ素は生物の生命活動に不可欠です。 フッ素は、生物が正常に機能するために必要な元素と考えられています。 体内では、ハロゲンは交換可能であり、相乗作用と拮抗作用の両方が観察される場合があります。 54.エアロゾル エアロゾルは、ガス状の分散媒体を含む分散システムです。 分散相の凝集状態に応じて、霧は区別されます - 液体分散相を持つエアロゾル。 煙霧、粉塵 - 固体分散相を含むエアロゾル。 スモッグ - 混合分散相を含むエアロゾル。 エアロゾルの分散相の粒子サイズは、分散システムの分類に従って、107 10へ9 メートル 他の分散システムと同様に、エアロゾルは凝縮と分散の XNUMX つの方法で得られます。 凝縮法 分散相は、分子を凝縮してコロイドサイズの粒子にする物理的プロセスによって蒸気相から得られます。 分散方法 コロイドサイズの粒子は、より大きな凝集体を粉砕することによって得られます。 エアロゾルには光を散乱させる性質があります。 エアロゾルの分散相の粒子には二重の電気層はありませんが、分散相の粒子は電荷を帯びていることがよくあります。 電荷は、摩擦の結果として、またはガスイオンの吸着により発生します。 非常に多くの場合、エアロゾル粒子 (大小) は反対の符号の電荷を帯びていることに注意してください。 大量のエアロゾル中の粒子をサイズごとに高さごとに分離すると、高強度の電界が発生する可能性があります。 したがって、雲の中で放電、つまり稲妻が発生します。 エアロゾルは、相境界に二重の電気層がないため、速度論的および集合的に不安定なシステムです。 したがって、エアロゾルはリオゾルよりも速い速度で凝固します。 医学では、エアロゾルは吸入療法で使用され、損傷した皮膚を保護し、消毒します。 エアロゾルの形成が非常に望ましくない場合があります。 人間の健康に有害なエアロゾルは、鋳物工場、セラミックス、およびさまざまな鉱物 (鉱石、石炭、アスベストなど) の抽出および加工中に生成されます。 石炭粒子を含むエアロゾルは、炭疽症、酸化ケイ素 (IV) - 珪肺、アスベスト - 石綿肺などの肺疾患を引き起こします。 アレルギー疾患は、植物の花粉、綿、亜麻、麻などの加工時に発生する粉塵によって形成されるエアロゾルによって引き起こされます。細菌、カビ、ウイルスの懸濁液(微生物学的または細菌性エアロゾル)は、感染症の伝播経路の XNUMX つです。結核、インフルエンザ、急性呼吸器疾患。 燃料の燃焼中に発生するエアロゾルは、分散相に煤、樹脂、灰、発がん性のある炭化水素が含まれており、人体に悪影響を及ぼします。 スモッグは特に健康に危険です。 したがって、粉塵や大気汚染との戦いはますます重要になっています。 エアロゾルからの空気浄化は、フィルター、サイクロン (遠心集塵機)、および高電圧電場を使用して分散相の粒子を捕捉する、無駄のない技術を導入することによって実現されます。 55. エマルジョン エマルションは、分散相と分散媒が混和しない液体である微小不均一系です。 分散相 - 液滴 - の粒子サイズは、104 から 106 m の範囲です。 分散相の濃度に応じて、エマルジョンは希釈、濃縮、高濃縮に区別されます。 分散相と分散媒の性質に応じて、次のようなものがあります。 1)極性液体(DS)中の非極性液体(DF)のエマルジョン - 第一種のエマルジョンまたは「油/水」タイプ(O / W)のエマルジョンと呼ばれる直接エマルジョン。 2) 非極性液体 (DS) 中の極性液体 (DF) のエマルション - 第 XNUMX 種のエマルションまたは「水 / 油」タイプ (W / O) のエマルションと呼ばれる逆エマルション。 ここで、DF と DS はそれぞれ分散相と分散媒であり、「水」は任意の極性液体、「油」は無極性液体です。 エマルジョンタイプを設定できます: 1) 電気伝導率の測定; 2)過剰の極性または無極性液体と混合する。 3) 水溶性または油溶性染料による染色。 4)疎水性または親水性の表面上での乳剤滴の湿潤および拡散による。 エマルジョンは、他の分散システムと同様に、 濃縮分散法により得られる。 粗い分散としてのエマルションは、速度論的および凝集的に不安定なシステムです。 分散相の液滴が衝突すると、それらは合体します (合体)。 合体の結果、エマルションは XNUMX つの連続した液相に分離します。 エマルジョンの安定性を高めるために、安定剤、つまり乳化剤が使用されます。 これらは、界面での吸着の結果、界面張力を低下させ、機械的に強力な吸着膜を形成する界面活性剤です。 乳化剤がイオン性界面活性剤の場合、分散相の液滴に同じ符号の電荷を与え、液滴は反発します。 形成されるエマルションのタイプは、乳化剤の特性によって異なります。 分散媒は常に、乳化剤を最もよく溶解または濡らす液体です。 高級脂肪酸の塩、高級脂肪酸と多価アルコールのエステル、長鎖アミンが乳化剤として使用されます。 エマルションは自然界に広く存在します。 乳液は牛乳、クリーム、サワークリーム、バター、卵黄、乳白色の植物ジュース、原油です。 薬用物質を含む乳剤は、医療において広く使用されており、内服用の第 XNUMX タイプ (O/W) と外用の第 XNUMX タイプ (W/O) があります。 植物性脂肪や動物性脂肪は、乳化した形(牛乳)の方が体に吸収されやすいことが知られています。 この場合、コール酸およびデオキシコール酸の誘導体が乳化剤として作用します。 場合によっては、得られたエマルションを破壊する必要がある場合があります。 エマルションが壊れることを解乳化といいます。 解乳化は、温度の上昇と下降、電場への曝露、遠心分離、電解質と特別な物質(解乳化剤)の添加によって実行されます。 抗乳化剤は、乳化剤よりも高い界面活性を持つ界面活性剤ですが、機械的に強力な吸着層を形成する能力はありません。 56. コロイド状界面活性剤 コロイド状界面活性剤とは、同じ溶媒でも条件によって真のコロイド溶液を形成する物質です。 すでに述べたように、界面活性剤分子は両親媒性です。 それらは、非極性グループと極性グループで構成されます。 非極性ラジカル、たとえば炭化水素鎖は、極性溶媒である水に対して親和性を持ちませんが、極性基に対しては親和性が非常に高くなります。 非極性基間には疎水性 (ファンデルワールス) 相互作用が存在します。 チェーンの長さ約1022 炭化水素ラジカルの疎水性相互作用と極性基と水との強い相互作用により、炭素原子が結合すると、界面活性剤分子が会合し、ミセルが形成されます。 溶液中でミセルが形成されるコロイド状界面活性剤の最小濃度は、臨界ミセル濃度 (CMC) と呼ばれます。 結果として得られるミセルの形状は、溶液の濃度に依存します。 低濃度のコロイド状界面活性剤では、球状ミセルが形成されます。 コロイド状界面活性剤溶液の濃度の増加は、最初にそれらの数の増加につながり、次に形状の変化につながります。 高濃度では、球状ミセルの代わりに、円筒状および層状ミセルが形成されます。 CMC値は、コロイド状界面活性剤の性質、温度、異物、特に電解質の不純物の存在など、さまざまな要因に依存します。 CMC は、動的に活性な粒子の数とサイズに応じた溶液の特性、特に浸透圧、表面張力、導電率、および光学特性の変化によって決定できます。 「真の溶液-コロイド溶液」の遷移中に、運動学的に活性な粒子(イオン、分子、ミセル)のサイズとその数が変化するため、CMCに対応する変曲点が「性質-濃度」のグラフに表示されます。 コロイド状界面活性剤溶液の最も重要な特性の XNUMX つは、それらが国民経済のさまざまな分野や医療で広く使用されているため、可溶化です。 可溶化のメカニズムは、ミセルの疎水性コアにおける非極性物質の溶解にあります。 可溶化現象は、食品産業、製薬産業(液体の医薬物質を取得するため)など、国民経済のさまざまな分野で広く使用されています。 水-リン脂質系では、振とうと撹拌により球状ミセル、つまりリポソームが形成されます。 リン脂質分子はリポソーム内で二重膜を形成しており、極性基が水に面し、非極性基が互いに面しています。 リポソームは生体膜のモデルと考えることができます。 彼らの助けを借りて、さまざまな化合物の膜の透過性とそれに及ぼすさまざまな要因の影響を研究することができます。 リポソームは、特定の臓器や患部への薬物の標的送達に広く使用されています。 リポソームは薬物を細胞に輸送することができます。 リポソーム膜は、抗体と抗原間の相互作用を研究する免疫学的研究で使用されます。 著者: Drozdova M.V.、Drozdov
タッチエミュレーション用人工皮革
15.04.2024 Petgugu グローバル猫砂
15.04.2024 思いやりのある男性の魅力
14.04.2024
▪ サイトのアマチュア無線に関するヒントのセクション。 記事の選択 ▪ 記事 木星、土星、海王星はどのような点で古典的な惑星の定義に完全には当てはまらないのでしょうか? 詳細な回答 ▪ 記事 初心者アマチュア無線。 無線。 無線エレクトロニクスと電気工学の百科事典 ▪ Ericsson 8xx、T1x、A1018 電話機用のケーブルのスキーム、ピン配列 (ピン配置) の記事。 無線エレクトロニクスと電気工学の百科事典
ホームページ | 図書館 | 物品 | サイトマップ | サイトレビュー www.diagram.com.ua |






 Arabic
Arabic Bengali
Bengali Chinese
Chinese English
English French
French German
German Hebrew
Hebrew Hindi
Hindi Italian
Italian Japanese
Japanese Korean
Korean Malay
Malay Polish
Polish Portuguese
Portuguese Spanish
Spanish Turkish
Turkish Ukrainian
Ukrainian Vietnamese
Vietnamese

 他の記事も見る セクション
他の記事も見る セクション 