
|
|
病院療法。 講義ノート: 簡単に言うと、最も重要なこと
目次
講義番号1。心血管系の病気。 リウマチ リウマチ (Sokolsky-Buyo病)は、心血管系のプロセスの主な局在を伴う結合組織の全身性炎症性疾患であり、急性感染症により、その素因のある人(原則として、これらは若者)に発症しますグループAのβ溶血性連鎖球菌。 この病気の定義は、1989年にV. A. Nasonovによって与えられました。 それは病気のすべての特徴を反映しています: 1) 心血管系への主な損傷; 2) 病的遺伝の役割; 3)レンサ球菌感染の意義。 この病気の本質は、心臓のすべての膜の破壊にありますが、主に心筋と心内膜が弁膜装置の変形を引き起こします-心臓病とそれに続く心不全の発症。 リウマチにおける他の臓器やシステムの敗北は二次的な重要性であり、その重症度とその後の予後を決定するものではありません. 病因。グループ A ベータ溶血性連鎖球菌は、上気道に損傷を引き起こします。一般にリウマチの発症に先立って、喉の痛み、慢性扁桃炎の増悪、連鎖球菌抗原と抗連鎖球菌抗体(ASL-O、ASG、ASA、抗デオキシリボヌクレアーゼB(抗DNase)の量の増加が起こるのはそのためです) B)) は病人の血液から検出されます。 以前の連鎖球菌感染症とのそのような関係は、多発性関節炎を伴うリウマチの急性経過で特に顕著です。 リウマチの発症には、年齢および社会的要因(不利な生活条件、栄養失調)が関与し、遺伝的素因も重要です(リウマチは多遺伝子遺伝性疾患であり、「リウマチ」ファミリーの存在はよく知られています)。連鎖球菌抗原に対する過免疫反応、自己免疫および免疫複合体プロセスに対する患者の傾向。 病因。リウマチでは、多数の連鎖球菌抗原に対して複雑で多様な免疫反応(即時型および遅発型過敏反応)が発生します。感染症が体内に侵入すると、抗連鎖球菌抗体が生成され、免疫複合体(連鎖球菌抗原 + それらに対する抗体 + 補体)が形成され、血液中を循環して微小循環床に定着します。連鎖球菌の毒素や酵素も、心筋や結合組織に損傷を与えます。 免疫系の遺伝的に決定された欠陥のために、連鎖球菌抗原と免疫複合体は、患者の体から完全かつ迅速に排除されません。 そのような患者の組織は、これらの免疫複合体を固定する傾向が高まっています。 交差反応性抗体もここで役割を果たし、連鎖球菌抗原上に形成され、心臓を含む体の抗原を含む組織と反応することができます。 それに応じて、炎症は免疫ベースで発生し(即時型過敏症のタイプに応じて)、炎症プロセスを実行する要因は、免疫複合体を貪食すると同時に破壊される好中球のリソソーム酵素です。 この炎症過程は、主に心血管系の結合組織に局在し、それと心筋の抗原特性を変化させます。 その結果、自己免疫プロセスは遅延型過敏症のタイプに応じて発達し、心臓組織と反応するリンパ球が患者の血液中に見られます。 これらの細胞は、臓器病変(主に心臓)の起源において非常に重要です。 リウマチを伴う結合組織では、相変化が起こります:ムコイド腫脹-フィブリノイド変化-フィブリノイド壊死。 免疫障害の形態学的発現は、細胞反応であり、リンパ球および形質細胞による浸潤、リウマチ性またはアショフ-タララエフスキー肉芽腫の形成です。 病理学的プロセスは硬化症で終わります。 リウマチ性心疾患における心臓損傷のもう XNUMX つの形態学的基質は、関節および漿液膜におけるものと同様の非特異的炎症反応です。筋肉間結合組織の腫れ、フィブリン発汗、好中球およびリンパ球による浸潤です。 病気は波状に流れ、感染または非特異的要因(低体温、身体的ストレス、ストレスなど)の影響下で悪化します。これは、病理学的プロセスの自己免疫性に関連しています。 心臓が損傷を受けると、炎症過程が心臓のすべての膜に広がる (汎心炎) か、各膜に孤立して広がる可能性があります。 リウマチの形態学的変化は主に心筋に見られるため、臨床像を決定するのは初期段階の心筋炎です。 心内膜の炎症性変化(弁膜炎、いぼ状心内膜炎)、腱フィラメントの損傷、および線維輪は、リウマチの発作の6〜8週間後に臨床的に検出されます。 僧帽弁が最も一般的に影響を受け、続いて大動脈弁と三尖弁が影響を受けます。 リウマチの肺動脈弁が影響を受けることはほとんどありません。 リウマチの分類。現在、リウマチの分類と命名法は、全連合リウマチ学会によって 1990 年に承認され、プロセスの段階、臓器やシステムへの損傷の臨床的および解剖学的特徴、経過の性質を反映して採用されています。心血管系の機能状態 (表 1 を参照)。 臨床画像。この病気のすべての症状は心臓性と心臓外に分類できます。病気の臨床像はこれらの立場から説明できます。 ステージ I: 病気と感染症との関連が明らかになります。 典型的なケースでは、喉の痛みや急性呼吸器疾患の 1 ~ 2 週間後に体温が上昇し、時には 38 ~ 40 °C まで上昇し、日中の変動は 1 ~ 2 ° C 以内で、強い汗をかきます (通常は悪寒はありません)。 リウマチの繰り返しの発作で、病気の再発はしばしば非特異的要因(低体温症、身体的過負荷、手術など)の影響下で発症します。 表1 リウマチの分類
リウマチの最も一般的な症状は、心臓の損傷です。リウマチ性心疾患:心筋と心内膜への同時損傷です。 成人では、リウマチ性心疾患は重篤ではありません。 患者は、心臓領域の軽度の痛みや不快感、運動中のわずかな息切れ、中断や動悸を訴えることはほとんどありません。 これらの症状はリウマチ性心疾患に特有のものではなく、他の心疾患でも見られることがあります。 このような苦情の性質は、診断検索の後続の段階で指定されます。 若い患者のリウマチ性心疾患は、原則として重度です。病気の最初から、運動中および安静時の重度の息切れ、心臓の絶え間ない痛み、動悸が見られます。 右季肋部の浮腫と重さの形で、大きな円で循環不全の症状が現れることがあります(肝臓の増加による)。 これらの症状はすべて、重度のびまん性心筋炎を示しています。 心膜炎、およびリウマチの心臓外症状はまれです。 乾性心膜炎の発症に伴い、患者は心臓の領域に一定の痛みしか見られません。 心臓嚢に漿液性線維性滲出液が蓄積することを特徴とする滲出性心膜炎では、炎症を起こした心膜層が蓄積する滲出液によって分離されるため、痛みが消えます。 息切れが現れ、患者の水平位置とともに増加します。 右心への血流が困難なため、大きな円でうっ血が現れます(浮腫、肝臓の増加による右季肋部の重さ)。 リウマチの最も特徴的な特徴は、リウマチ性多発性関節炎の形での筋骨格系の敗北です。 患者は、大きな関節(膝、肘、肩、足首、手首)の痛みの急速な増加、能動的な動きの不可能性、関節の体積の増加に気づきます。 アセチルサリチル酸および他の非ステロイド性抗炎症薬の使用後、数日間、多くの場合、すべての関節症状が数時間緩和された後、迅速な効果があります. 腎臓のリウマチ性病変も非常にまれであり、尿の研究でのみ検出されます. リウマチにおける神経系の病変はまれであり、主に子供にみられます。 病訴は、異なる病因の脳炎、髄膜脳炎、脳血管炎の病訴と類似しています。 「小さな舞踏病」のみが注目に値します。これは子供(より多くの場合、女の子)に発生し、感情的な不安定さと体幹、手足、模倣筋肉の激しい運動亢進の組み合わせによって現れます。 腹部症候群(腹膜炎)は、急性原発性リウマチの小児および青年にほぼ独占的に発生します。 突然の発症、発熱、嚥下障害の兆候(びまん性または限局性のけいれん性の痛み、吐き気、嘔吐、滞留、または頻繁な便の発生)が特徴です。 診断検索のステージIIでは、心臓の損傷の兆候を検出することはほとんど重要ではありません。 原発性リウマチ性心臓病では、通常、心臓は肥大しません。 聴診は、こもったIトーン、時にはIIIトーンの出現、心尖部での柔らかい収縮期雑音を明らかにします。 この症状は、心筋の変化によるものです。 ただし、ノイズの強度、持続時間、持続性の増加は、僧帽弁不全の形成を示している可能性があります。 上記の聴診像を維持しながら、発作開始から6ヶ月後に欠陥の形成を自信を持って判断することができます。 大動脈弁が損傷した場合、ボトキン点で拡張期前雑音が聞こえることがあり、II トーンの響きが保持されることがあります。 数年後、重度の大動脈弁閉鎖不全が形成された後、右側の II 肋間スペースの II 緊張が弱まる (またはなくなる) と、この聴診徴候が加わります。 多発性関節炎の患者では、滑膜と関節周囲組織の炎症、関節の触診による痛みのために関節の変形が見られます。 影響を受けた関節の領域では、骨の隆起の上にある前腕とすねに位置するリウマチ性結節が現れることがあります。 これらは小さく、密度が高く、痛みのない形成物であり、治療の影響で消えます。 環状紅斑(リウマチにほぼ特徴的な兆候)は、腕と脚、腹部、首、体幹の内面の皮膚にあるピンク色の輪状の要素で、かゆみはありません。 この症状は非常にまれです (患者の 1 ~ 2%)。 リウマチ性肺炎と胸膜炎は、平凡な病因の同様の病気と同じ身体的兆候を示します。 一般に、非心臓病変は現在、リウマチの急性経過(高活動の存在下-III度)の若者では非常にまれにしか観察されません。 それらははっきりと表現されておらず、抗リウマチ療法中の発達を逆転させるのにすぐに適しています。 診断検索のIII段階では、実験室および機器研究のデータにより、病理学的プロセスの活動を確立し、心臓や他の臓器への損傷を明らかにすることができます。 活発なリウマチプロセスにより、臨床検査は非特異的な急性期と免疫学的パラメーターの変化を明らかにします。 急性期指標:白血球の血液処方が左にシフトする好中球増加症。 2-グロブリンの含有量の増加、それに続く-グロブリンのレベルの増加; フィブリノーゲン含有量の増加; C反応性タンパク質の出現; ESRが増加します。 免疫学的パラメーターに関しては、抗連鎖球菌抗体の力価が増加します(抗ヒアルロニダーゼおよび抗ストレプトキナーゼが1:300を超える、抗O-ストレプトリジンが1:250を超える)。 心電図は、リズムと伝導障害を明らかにすることがあります:一時的な房室遮断(より頻繁にI度 - P-Q間隔の延長、それほど頻繁ではありません - II度)、期外収縮、房室調律。 多くの患者では、負の歯が現れるまで T 波の振幅の減少が記録されます。 これらのリズムと伝導障害は不安定であり、抗リウマチ療法の過程ですぐに消えます。 心電図の変化が持続し、リウマチ発作の除去後も残る場合は、心筋への有機的損傷について考える必要があります。 心音図検査中に、聴診データが指定されます:第XNUMXトーンの弱体化、第XNUMXトーンの出現、収縮期雑音。 心臓病の形成の場合、弁病変の性質に対応する変化がPCGに現れます。 リウマチの最初の発作時のX線、変化は検出されません。 子供や若者の重度のリウマチ性心疾患の場合にのみ、左心室の拡張による心臓の増加を検出できます。 既存の心臓病を背景にリウマチ性心臓病が発症すると、X線写真は特定の欠陥に対応します。 原発性リウマチ性心臓病の心エコー検査では、特徴的な変化は見られません。 心エコー図に心不全の兆候がある重度のリウマチ性心臓病でのみ、心筋の収縮機能の低下と心腔の拡張を示す兆候が見られます。 診断法。多発性関節炎や心臓損傷などの最も一般的な症状は非特異的であるため、原発性リウマチを認識することは非常に困難です。現在、米国心臓協会のリウマチに対するメジャーおよびマイナー基準が最も広く使用されています。 1973 つの主要な基準、または 2 つの主要な基準と 3 つの軽微な基準の組み合わせは、以前に連鎖球菌に感染した場合にのみ、リウマチの可能性が高いことを示しています。 リウマチが徐々に発症するにつれて、XNUMX 年に AI Nesterov によって提案された症候群診断 (表 XNUMX を参照) が問題になります。臨床的および疫学的症候群 (連鎖球菌感染との関連)。 臨床的および免疫学的症候群(不完全な回復期、関節痛、抗連鎖球菌抗体の力価の上昇、ならびに異常タンパク質血症および急性期指標の検出の兆候); 心血管症候群(心炎および心臓外病変の検出)(表XNUMXを参照)。 表2 リウマチの基準
表3 リウマチの程度
差動診断。リウマチ性多発性関節炎は、非リウマチ性多発性関節炎と区別する必要があります (表 4 を参照)。 表4 リウマチ性および非リウマチ性多発性関節炎
リウマチに関連して、以下の病気と症状が疑われます。 1) 心内膜炎; 2) 心筋炎; 3)心膜炎; 4)心臓の欠陥; 5)リズムと伝導障害; 6) 急性および慢性心不全; 7)長期の亜熱性状態; 8)結節性紅斑; 9) 環状紅斑; 10)皮下結節; 11) 急性アレルギー性多発性関節炎; 12)舞踏病。 上記の臨床症候群はいずれもこの疾患に特有のものではありません。 リウマチの少なくともXNUMXつの心臓外の主な症状と心臓の病状の組み合わせだけがリウマチを疑う理由を与えます。 リウマチ性心疾患自体の認識は、息切れや動悸、倦怠感、心臓領域の痛みや心調律障害、騒音、時には奔馬調律、Iトーンの弱化などの症状に基づいて行われます。 リウマチ性心臓病の診断において非常に重要なのは、ECGでの病状の特定です。 リウマチでは、心筋炎、心膜炎、心臓の欠陥によって引き起こされます。 動的な観察により、欠陥の場合の心臓のさまざまな部分の肥大に特徴的な不可逆的な変化を一過性のものから区別することが可能になり、現在の炎症過程を示します。 治療。治療におけるプラスの効果、および心臓病の発症の予防は、経過の種類、病理学的プロセスの活動性、心炎の重症度の評価に基づく早期診断と個別の治療によって促進されます。心臓弁膜症の変種。心筋、他の組織や臓器の状態、患者の職業などが重要です。 したがって、リウマチの治療の複合体全体は、抗菌および抗炎症療法、免疫学的恒常性の回復を目的とした対策で構成されています。 合理的なバランスの取れた食事を使用し、身体活動への適応、仕事の準備、複雑な心臓欠陥のある患者のタイムリーな外科的治療に焦点を当てることをお勧めします。 リウマチの活動期にあるすべての患者にペニシリン(1日200回、000時間ごとに1〜500 IU)が表示されます。これは、すべてのタイプのA連鎖球菌に殺菌効果があります。 治療期間はリウマチの活動期の000週間であり、将来的には、長期投与薬のビシリン-6(4万単位)への移行が必要になります。 ペニシリンに不耐性の場合、エリスロマイシン2mgを5日1回処方することができます。 リウマチの活動期の現代的な治療に使用される抗炎症効果のある薬は、グルココルチコステロイド、サリチル酸、インドール誘導体、フェニル酢酸の誘導体などです。 プレドニゾロンは、IIIおよびIIの原発性および再発性の場合、20日あたり30〜2 mg(2,5週間、その後5〜5日ごとに7〜1,5 mgずつ、合計2〜12か月間)使用されます。活動性心臓炎による心不全の発症を伴う、多発性漿膜炎および舞踏病を伴うリウマチ性心臓病のプロセスの程度の活動。 後者の場合、電解質バランスを乱す能力がほとんどないため、16日あたりXNUMX〜XNUMXmgの用量のトリアムシノロンが好ましい。 コルチコイド薬は水と塩の代謝に影響を与えるため、塩化カリウム3〜4 g /日、パナンギンなどを治療に使用し、体液貯留を行う必要があります-アルドステロン拮抗薬(6日あたり最大8〜40錠のベロシュピロン)、利尿薬(ラシックス) 80〜40mg /日、フロセミド80〜XNUMXmg /日など)、多幸感 - 精神安定剤など 非ステロイド性抗炎症薬もリウマチに広く使用されています。アセチルサリチル酸の平均投与量は3日あたり4〜5 gで、XNUMX日あたりXNUMXg以上になることはあまりありません。 サリチル酸塩の使用の適応症: 1) 最小限の活動度、軽度の心臓炎、主に心筋炎; 2)リウマチの長期治療、潜在的な経過の疑い; 3)プロセスの過程での活性の低下とコルチコステロイドの使用の中止を伴う長期治療、および病院での治療の完了後; 4)サリチル酸塩は体液を保持できず、血餅の形成を防ぎ、呼吸中枢の刺激物であるため、重度の心臓欠陥および循環不全を背景に発生する再発性リウマチ性心疾患。 5) 春と秋のリウマチの悪化の可能性を減らすだけでなく、併発感染症に苦しんだ後も (抗生物質と一緒に)。 アセチルサリチル酸は、1 gを3日4〜1回、食後に3〜XNUMXか月以上使用しますが、通常の耐性があり、副作用が抑えられます。 20年以上にわたるリウマチにおけるインドメタシンのインドール酢酸誘導体の使用の成功。 それは顕著な治療効果を持っています:心炎の主観的症状(心臓痛、動悸、息切れ)は治療の8〜10日目までに消え、客観的な兆候は14〜16日目までに消えます。 多発性関節炎および多発性漿膜炎の消失はさらに速く起こります。 リウマチの治療では、病院 - 診療所 - リゾートという XNUMX つの主な段階の組み合わせが重要です。 病院では、上記の薬で治療を行っています。 リウマチの活動を減らし、患者の状態を正常化した後、それらはステージIIに移されます-リウマチ療養所での治療。 この段階の主な目標は、病院で個別に選択された非ステロイド性抗炎症薬、アミノキノリン誘導体、ビシリン-5、リハビリテーションによる治療の継続です。 ステージ III には、診療所での観察と予防的治療が含まれます。 これは、リウマチ過程の活発な経過を最終的に排除することを目的とした治療措置の実施です。 心臓病患者の循環障害の対症療法の実施; リハビリテーション、労働能力、雇用の問題を解決する。 リウマチの一次予防と再発の二次予防の実施。 講義番号2。心血管系の疾患。 心筋症。 拡張型心筋症 1. 心筋症 心筋症 - 未知の病因(特発性)の非炎症性の一次孤立心筋病変、それらは弁欠損症または心臓内シャント、動脈または肺高血圧症、冠状動脈性心臓病または全身性疾患(例えば:コラーゲン症、アミロイドーシス、ヘモクロマトーシス、など)、そして病気の最終段階では、重度のうっ血性心不全と、心臓のリズムと開存性の複雑な障害が発生します。 心筋症の分類は次のとおりです。 1) 拡張型心筋症: a) 特発性; b)有毒; c)感染性; d) コラーゲン症を伴う; 2) 肥大; 3) 制限的。 4) 右心室の不整脈性異形成; 5) 4 種類の心筋症の XNUMX つと動脈性高血圧症の組み合わせ。 2. 拡張型心筋症 拡張性心筋症(DCM)は、心臓のすべての心室(主に左心室)のびまん性拡張を特徴とする心筋の疾患であり、心臓のポンプ機能の病態が前景にあり、その結果、 、慢性心不全(したがって、心臓が血液を完全に送り出すことができず、心臓が体の組織や器官に「停滞」する場合、XNUMX番目の名前はうっ血性です)。 心臓の筋肉壁は変化しないか、さまざまな程度で肥大したままです。 DCM の開発に先立つ疾患と要因を以下の表に示します (表 5 を参照)。 表5 DCMPの開発に先立つ疾患と要因
これは、心筋への損傷の最も一般的な形態です。 発生率は、年間 5 万人あたり 8 ~ 100 例です。 これらの患者には明確な家族歴はありません。 男性は女性よりも 000 ~ 2 倍頻繁に病気になります。 病因。心筋の炎症過程(心筋炎)の結果、そのさまざまな部分で個々の細胞の死が起こります。この場合、炎症は本質的にウイルス性であり、ウイルスの影響を受けた細胞は体にとって異物となります。したがって、抗原が体内に現れると、その破壊を目的とした免疫応答反応の複合体が発生します。死んだ筋肉細胞は徐々に、心筋本来の伸張性と収縮性の能力を持たない結合組織に置き換えられます。基本的な心筋機能の喪失の結果、心臓はポンプとして機能する能力を失います。これに反応して(代償反応として)、心臓の部屋が拡張し(つまり、拡張し)、心筋の残りの部分で肥厚と圧縮が発生します(つまり、心筋肥大が発生します)。体の臓器や組織への酸素の供給を増やすために、持続的な心拍数の増加が発生します(洞性頻脈)。 この代償反応は、心臓のポンプ機能を一時的に改善するだけです。 しかし、心筋の拡張および肥大の可能性は、生存可能な心筋の量によって制限され、疾患の特定のケースごとに異なります。 プロセスが代償不全の段階に移行すると、慢性心不全が発症します。 ただし、この段階では、別の代償メカニズムが働きます。体の組織は、健康な体と比較して、血液からの酸素の抽出を増加させます。 しかし、心臓のポンプ機能が低下すると、臓器や組織の正常な機能に必要な酸素の供給が減少し、二酸化炭素の量が増加するため、このメカニズムは不十分です。 病気の後期の心室の空洞にいる患者の2/3で、壁側血栓が形成されます(心臓のポンプ機能の低下、および心腔内の心筋の不均一な収縮のため) )、続いて肺または体循環における塞栓症の発症。 心臓の病理組織学的および病理形態学的変化。 心臓の形は球形になり、その質量は主に左心室のために500から1000gに増加します。 心筋はたるんだ、鈍くなり、結合組織の顕著な白っぽい層があり、肥大した心筋細胞と萎縮した心筋細胞の特徴的な交代があります。 微視的に、びまん性線維症が検出され、心筋細胞の萎縮と肥大の両方と組み合わせることができ、核の体積、ミトコンドリアの数、ゴルジ体の過形成、筋原線維の数の増加が大幅に増加します、無料で、豊富なグリコーゲン顆粒である小胞体リボソームと関連しています。 臨床画像。病気の具体的な兆候はありません。臨床像は多態性があり、以下によって決定されます。 1) 心不全の症状; 2) リズムと伝導障害; 3) 血栓塞栓症候群。 これらの現象はすべて疾患の終末期に発症するため、これらの症状が現れる前に DCM を認識することは非常に困難です。 ほとんどの場合、病気の予後は心臓の左心室の敗北によって決定されます。 心不全の発症前に、DCMは潜在的です。 すでに発症している心不全の最も頻繁な不満は、パフォーマンスの低下、倦怠感の増加、運動中の息切れ、そして安静時の不満です。 夜、彼は乾いた咳(心臓喘息に相当)を起こし、その後、典型的な喘息発作を起こします。 患者は特徴的な狭心症の痛みを示します。 体循環のうっ血が進行すると、右季肋部に重さが現れ(肝臓が肥大するため)、脚が腫れます。 診断法。この病気を診断する場合、重要な兆候は心臓の顕著な拡大です (心臓弁膜症や動脈性高血圧の兆候はありません)。心肥大は、打診によって決まる心臓の両方向への拡張と、心尖拍動の左下への変位によって現れます。重症の場合には、ギャロップ調律、頻脈、および僧帽弁または三尖弁の相対的な機能不全を示す音が聞こえます。心房細動は症例の 20% で発症します。血圧は通常正常か、わずかに上昇しています(心不全のため)。 血液と尿の生化学的研究は、ビタミン欠乏症だけでなく、さまざまな毒性物質を検出することができます。 機器の調査方法により、以下を検出できます。 1) 心肥大の徴候; 2) 中枢血行動態の指標の変化; 3)リズムと伝導障害。 心電図に特徴的な変化がないか、シフトが非特異的です。 これらは、心臓のサイズの増加、房室束の左脚の前枝の閉塞(彼の束)の形での伝導障害、または左脚の完全な閉塞の兆候です(症例の15%) ); 持続性洞性頻脈 (心拍数が毎分 100 回を超えることが多い)。 心音図は、(僧帽弁または三尖弁の相対的な機能不全による)収縮期雑音のかなり頻繁な検出であるギャロップリズムの形で聴診データを確認します。 肺循環のうっ血により、II トーンのアクセントが現れます。 X線は、心室の有意な増加(多くの場合、左心房の中程度の増加と組み合わせて)と、肺(小)循環における血液の停滞を明らかにします. 肺循環の違反は、肺血管パターンの増加、および肺の血管内の圧力の上昇により形成される胸腔内の浸出液の出現によって明らかになります。 心エコー検査の方法は、病気の診断における主要な方法のXNUMXつです。 心エコー検査は、両方の心室の拡張、左心室の後壁の運動低下、収縮期の心室中隔の逆説的な動きを検出するのに役立ちます。 さらに、心エコー検査では、僧帽弁の未変化の弁尖の動きの振幅の増加を明らかにすることができます。 診断を行うために追加の機器研究は必須ではありませんが、それらの結果により、血行力学的障害の程度と心筋の形態学的変化の性質を詳細に説明することができます。 心臓の放射性同位体研究(心筋シンチグラフィー)は、心臓のポンプ機能の状態を明らかにし、死んだ心筋のゾーンを決定するために行われます。 中枢血行動態の指標の研究により、肺動脈内の圧力の上昇である、分および一回拍出量(分および一回拍出量指数)が低いことが明らかになりました。 心エコー検査では、心エコー図と同じ変化が検出されます。 生の心筋生検は、心筋症の病因を決定するために有益ではありません。 場合によっては、ウイルス抗原またはLDHの含有量の増加、ならびにミトコンドリアによるエネルギー産生の減少が生検で検出されることがあります。 ただし、この外科的方法は、病気の病因とさらなる治療法を明らかにするために使用することができます。 操作は次のように行われます。局所麻酔下で、大きな動脈と静脈に穴を開け(穿刺)、最後に小さなはさみが付いた特別な器具をその経路に沿って心臓に通します。 心筋生検と冠動脈造影(心臓に供給する冠状動脈への造影剤の注入)を組み合わせると、DCMと同様の症状を持つ疾患のXNUMXつとして患者の冠状動脈疾患を除外することが可能になります。 これらの XNUMX つの研究は、X 線テレビの制御下で行われます。 差動診断。これは主に心筋炎や心筋ジストロフィー、つまり、不当に二次性心筋症と呼ばれることがある症状で発生します。 心筋生検は、拡張型心筋症と心臓病の鑑別診断において重要な助けとなります。 1) 重度のびまん性心筋炎では、間質の細胞浸潤が、心筋細胞のジストロフィーおよび壊死性変化と組み合わせて見られます。 2) 心臓の損傷を伴う原発性アミロイドーシス (原発性アミロイドーシスのいわゆる心疾患変異体) では、筋線維の萎縮と相まって、心筋の間質組織にアミロイドの顕著な沈着があります。 3)ヘモクロマトーシス(鉄代謝の違反によって引き起こされる病気)では、鉄含有色素の沈着が心筋に見られ、さまざまな程度の筋線維のジストロフィーと萎縮、および結合組織の増殖が観察されます。 DCMの変種として、薬物誘発性および毒性の心筋症を考慮することができます。 エタノール、エメチン、リチウム、カドミウム、コバルト、ヒ素、イソプロテレノール、その他の毒物など、多くの薬剤が心筋に毒性損傷を引き起こす可能性があります。 心筋の組織の組織病理学的変化は、限局性ジストロフィーとして現れます。 将来的には、末梢の炎症反応を伴う微小梗塞の発症が起こります。 有毒な心筋症の最も顕著な例は、過剰なビールを飲む人々に発生する心筋症です。 これは、泡を改善するためにビールに添加されるコバルトが含まれているためです。 コバルトはビタミンBの作用をブロックします1、また、細胞の酵素プロセスの変化に直接影響します。 コバルト心筋症の経過の急性期では、水腫性および脂肪変性の存在、細胞内小器官の破壊、および心筋細胞の限局性壊死が認められる。 将来的には、びまん性または小焦点の間質性線維症が発症し、最終的な結果は広範な瘢痕の形成です。 コバルト心筋症は、アルコール性心筋症よりも重症です。 診断が時間通りに行われた場合、患者の臨床的治癒が観察されます。 アルコール性心筋症。 エタノールは、心筋細胞に対して直接的な毒性効果があります。 さらに、慢性的なエチル中毒では、栄養が不足していることがよくあります。 アルコールは、心筋細胞の活動に必要なエネルギーが不足しているため、心筋細胞内の脂肪酸の伝達につながることが証明されています。 アルコールの代謝中に形成されるアセトアルデヒドは、タンパク質合成に対する直接的な毒性効果の要因となる可能性があります。 アルコール依存症は、潜伏ウイルスの活性化も伴います。 肉眼的には、心筋はたるんだ、粘土のようなもので、時には小さな傷跡が見られます。 冠動脈は無傷です。 顕微鏡検査は、ジストロフィー(水腫性および脂肪性)、心筋細胞の萎縮および肥大の組み合わせ、おそらく心筋細胞の溶解および硬化の病巣の存在を示す。 心筋の影響を受けた領域は、変化していない領域とは対照的です。 心臓生検標本の電子顕微鏡検査では、アルコール性心筋症の特徴である心筋細胞の筋小胞体および T 系の嚢胞性拡張が示されます。 アルコール性心筋症の合併症 - 心室細動または慢性心不全、血栓塞栓症候群の結果としての突然死。 治療。心筋症の治療は、その発生の具体的な原因が不明であるため、困難な課題です。 DCM の治療の一般原則は、慢性心不全の治療と大きく変わりません。続発性 DCM の場合は、以前の病気(心臓弁膜症など)を追加治療し、DCM の原因を除去するためにあらゆる手段が講じられます。 本質的に、心筋症患者の治療について話すことができるのは、臨床症状が現れたときだけです。 心不全では、強心配糖体は無効です。 患者はすぐに薬物に対する不耐性(グリコシド中毒)を発症するため、体から急速に排泄されるグリコシド(ストロファンチン、イソラニド)を使用する必要があります。 末梢血管拡張薬は、特に付随する狭心症症候群(ニトロン、サスタク、ニトロソルビド)には非常に効果的です。 これらの薬は、配糖体や利尿薬では治療が困難な重度の心不全に処方する必要があります。 狭心症症候群では、抗狭心症薬、できれば長時間の硝酸塩(サスタク、ニトロン、ニトロソルビド)を使用する必要があります。 アドレナリン遮断薬は効果的です(心不全の徴候がない場合に処方されます)。 DCMPの最新の外科的治療法のうち、最も効果的なのは心臓移植(移植)です。 ただし、この操作を実行できる可能性は大幅に制限されます。 このため、現代の治療における心臓移植の代替として、DCM 患者の余命を延ばすために、僧帽弁と三尖弁の機能不全を解消することを目的とした再建手術が開発され、実施されています。 これらの弁の機能不全を手術で取り除くことで、病気の最終段階の発症を「遅らせる」ことができます。 DCM患者の心臓移植に代わるもうXNUMXつの方法は、左心室のサイズを小さくするために左心室を部分的に切除することでした(バティスト手術)。 少し前に、DCMP患者の治療のために、ペースメーカーの特別なモデルが開発されました。これにより、心臓の心室の働きを同期させることができます。 これにより、心臓の心室への血液の充填が改善され、心臓のポンプ機能が向上します。 別の問題として、小児における DCM を考慮する必要があります。これは、年間 5 人の小児あたり 10 ~ 100 のケースです。 この疾患は、乳児を含むさまざまな年齢層で発症する可能性があることは注目に値します。 子供のグループの研究で得られたデータは次のとおりです: 患者は治療の 000 つのオプション (プレドニゾロンによる単剤療法、ジゴキシンまたはプレドニゾロン + ジゴキシンによる単剤療法) を受けました。 治療の有効性は、治療前後の心拍数、呼吸数、駆出率、収縮率の状態で評価した。 得られた結果の分析は、幼児の拡張型心筋症の治療における最大の効果は、コルチコステロイドと配糖体(プレドニゾロンとジゴキシン)の組み合わせで達成されることを示しています。 主要な治療コース(プレドニゾロンを 3 日 2 mg/kg を 28 日間投与、ジゴキシン)の完了後、心拍数の顕著な減少、息切れの減少が見られました。 プレドニゾロンによる単剤療法を背景に、心拍数の低下が起こります。 ジゴキシンによる単剤療法は、頻脈と呼吸困難の減少につながります。 かなりの数の治療合併症が観察されたため、幼い子供に細胞増殖抑制薬を処方することはお勧めできません. 予防。 DCM の予防には、アルコール、コカインを避け、腫瘍化学療法中に心臓パラメータを注意深く監視することが含まれます。 幼い頃から体を硬くするのに役立ちます。 アルコール性 DCM でアルコールを完全に断つと、心臓の収縮性が改善され、心臓移植の必要がなくなる可能性があります。 ほとんどの場合、診断が心不全の段階で行われるという事実も、治療において否定的な結果につながる可能性があります。 拡張型心筋症の早期診断は、ランダムな(スクリーニング)心エコー検査で行うことができます。この心エコー検査は、毎年の健康診断の際や、この病気にかかっている遺伝のある人を調べるときに行われます。 この場合、DCMの薬物治療の有効性を高めることが可能です。 講義№3.心血管系の病気。 肥大型心筋症 肥大型心筋症 (HCM) は、心室心筋 (主に左) の非冠動脈疾患であり、心室中隔 (IVS) が右心室の空洞に突出し、壁が大幅に肥厚することを特徴とします。 、心室の内部容積の減少、心室心筋の収縮性の正常または増加、および弛緩障害(拡張機能障害)。 最も一般的なのは、心室中隔の孤立性肥大(孤立性肥大性大動脈下狭窄症 - IHSS)または心室の先端部分です。 分類。肥大の局在化による HCM の分類 (E.D. Wigle et al., 1985 追加)。 I.左室肥大。 1)個々の壁または心室のセグメントの心筋肥大が発生する非対称性肥大(IVS肥大を含む-左心室の流出路の閉塞の有無にかかわらず90%、心室中央-1%、左心室の頂端肥大- 3%、自由壁肥大は左心室とIVSの後部-1%)。 2) 心筋肥大が心室のすべての壁に及ぶ場合、左心室の対称 (同心) 肥大が 5% の症例で発生します。 Ⅱ. 膵臓の肥大。 心筋肥大が心臓の心室からの血液の正常な流出を妨げる場合、彼らはHCMの閉塞型について話します。 それ以外の場合、HCM は非閉塞性です。 病因。この病気は先天性または後天性のいずれかです。先天性HCMは常染色体優性遺伝します。同じファミリー内でも、HCM のさまざまな形態や変異体が観察されます。ほとんどの場合、心室中隔の非対称肥大は遺伝します。 後天性 HCM は、動脈性高血圧症の病歴を持つ高齢患者に発生します。 有病率は 0,02 ~ 0,05% です。 取得した HCM の開発の理由は完全には理解されていません。 提案された仮説の XNUMX つによると、出生前に後天性 HCM を有する個体は、心臓活動、特に心拍数の調節に関与する心臓のアドレナリン受容体に欠陥を発症します。 その結果、心拍数を増加させるノルエピネフリンおよび類似のホルモンに対する感受性が大幅に増加し、それらの心筋肥大の発生、そして最終的にはHCMに影響を与えます。 病理組織写真。心筋細胞および心筋細胞内の筋原線維の方向の乱れた、誤った、無秩序な配置、心筋線維症は、心筋の構造の違反です。 病因。血行力学的障害は、心臓の拡張機能の障害によって発生します。拡張期には、心室(特に左心室)の密度と硬さのため、不十分な血液が流れ込み、拡張末期圧力が急速に上昇します。心筋の硬さの増加と心室内圧の増加により、収縮期に心室から排出される血液が減少します。 体の臓器や組織に酸素を適切に供給するために(心血管系が正常に機能している場合)、負荷を実行するには、心臓からの血液の放出を増加させる必要があります。 したがって、負荷に応じて心拍数が増加します。 HCMの発症に伴い、安静時の心臓への血液の充填も損なわれ、運動中の心拍数の増加により、さらに悪影響を受けます。 この結果、HCM では運動中に心臓のポンプ機能が十分に増加しません。 HCMでの身体活動は、心室内圧の上昇に影響を与え、その結果、上にある左心房と小(肺)循環の血管の圧力が上昇します。 これらの条件下では、左心房の機能亢進と肥大が発生し、その後、肺高血圧症(「受動的」)が発生します。 その結果、負荷の程度に比例する息切れが発生します。 運動中、左心室からの血液の放出は負荷の増加に対応していないため、心筋自体に栄養を与える冠状動脈の血流が損なわれ始めます。 重要な役割を果たしており、HCMでは肥大型心筋のかなりの量と冠状動脈の血液供給の可能性との間に矛盾があり、それは健康な人と同じままです。 冠状動脈を通る血流の減少は、胸部の中央および左半分に狭心症の発生をもたらし、左肩甲骨の下で左腕に放射状に広がる。 息切れのように、狭心症は身体運動によって引き起こされます。 運動中のHCMのいくつかのケースでは、脳の血液供給も悪化し、失神を引き起こします。 運動中の心室内圧の上昇を抑えるために、左心房の空洞が拡張し、その壁の厚さが増加するという事実に基づいて動作する代償メカニズムがあることに注意してください。 その結果、運動中に左心室がさらに血液で満たされます。 ただし、これは、「ポンプ」としての左心房の予備が重要でなく、左心房の空洞の大幅な拡張が心房細動の発症につながるという事実による一時的な補償にすぎません。 臨床画像。 HCM は非常に多様な症状を特徴とし、誤診の原因となります。 HCM における愁訴の存在とタイミングは、主に HCM の形態と病変の位置という 2 つの要因によって決まります。心臓の最も強力な部屋は左心室であるため、心筋壁の肥大では、長い間症状が現れない可能性があります。心臓の右心室が単独で損傷を受けることは非常にまれです。 非閉塞性のHCMでは、心室からの血液の流出を妨げるものが何もない場合、患者は何の不満も示さない可能性があります。 時々、息切れ(かなりの運動を伴う)、心臓の働きの中断、および不整脈があるかもしれません。 閉塞性のHCMでは、心室からの血液の流出を妨げるものが存在するため、運動中の心臓からの血液の排出が大幅に減少します。 この場合、典型的な不満は、労作時の息切れ、狭心症、失神です。 この病気は、発症した瞬間から苦情がゆっくりと進行することを特徴としています。 病状 (心臓の領域と胸骨の後ろの痛み) と研究データ (強い収縮期雑音) が類似しているため、リウマチ性心疾患と冠状動脈性心疾患はほとんどの場合誤診されます。 HCM の臨床像は次のとおりです。 1) 心室心筋肥大の徴候 (主に左); 2)心室の拡張機能が不十分である兆候。 3) 左心室流出路閉塞のさまざまな徴候。 診断法。診断検索の過程で最も重要なのは、収縮期雑音、脈拍の変化、心尖拍動の変位の検出です。 閉塞性 HCM 患者の心臓の聴診画像には、多くの特徴があります。収縮期雑音 (駆出雑音) の最大音は、ボトキン ポイントと心臓の頂点で決定され、雑音の重症度は次の値に比例します。閉塞の程度、その激化は、患者が突然立ち上がったとき、およびバルサルバテスト中に発生します。 II トーンは常に保持されます。 首の血管にノイズが入りません。 脈拍は通常高く、速いです。 これは、収縮期の開始時に左心室からの流出路に狭窄がないためですが、その後、強力な筋肉の収縮により、流出路の「機能的な」狭窄が現れ、その結果、脈拍が波は早期に減少します。 約 1/3 の症例での心尖拍動には「二重」の特徴があります。最初に触診すると、左心房の収縮から、次に左心室の収縮から打撃が感じられます。 心尖拍動のこの特性を識別する便宜上、触診は、患者が左側に横たわっている状態で行うのが最適です。 HCMの診断には、心エコー検査データが最も重要であり、疾患の解剖学的特徴、心筋肥大の重症度、左心室の流出路の閉塞を明らかにすることができます。 次の兆候が明らかにされています:IVSの非対称肥大、上XNUMX分のXNUMXでより顕著、その運動低下。 僧帽弁の前尖の前方向への収縮運動; 僧帽弁の前尖と拡張期のIVSとの接触。 非特異的な徴候は、左心房の肥大、左心室の後壁の肥大、僧帽弁前尖の拡張期カバーの平均速度の低下です。 心電図では、特定の変化は左心室肥大が十分に発達している場合にのみ見られます。 心電図を 24 時間記録することにより (ホルター モニタリング)、既存の心拍リズム障害が検出されます。 自転車エルゴメーターまたはトレッドミルを使用した身体活動を伴う心電図検査により、疾患の症状の重症度、その予後を評価し、適切な治療法を開発することができます。 IVS の孤立した肥大は、左胸誘導 (V5-6) の Q 波の振幅の増加を引き起こし、心筋梗塞による焦点の変化を伴う鑑別診断を複雑にします。 ただし、Q 波の幅が狭いと、心筋梗塞を除外することができます.左心房の血行動態過負荷が発生する過程で、ECG は左心房肥大の兆候を示す場合があります:0,10 秒以上の P 波の拡大、増加その振幅では、V 誘導における二相性 P 波の出現1 XNUMX番目のフェーズでは、振幅と持続時間が増加しました。 X線診断は、左心室と左心房の増加、大動脈の下行部分の拡大を判断できる疾患の進行期にのみ重要です。 心音図では、大動脈弁口の狭窄による HCM の鑑別徴候である I および II トーンの振幅が保持され、さまざまな重症度の収縮期雑音も検出されます。 心エコー検査は診断を行うための非常に信頼できる情報を提供するため、侵襲的な研究方法(心臓の左部分のプロービング、造影血管造影法)は現在必須ではありません。 ただし、これらの方法は、診断を明確にするために物議を醸すケースで、または手術のために患者を準備する際に使用されることがあります。 心臓プロービングは、X線テレビの制御下で使用されます。 この方法を実行するための技術:局所麻酔下で大きな動脈を穿刺し、心臓腔に特別なカテーテルをさらに導入することにより、左心室とそれから離れる大動脈との間の圧力勾配(差)を測定する。 通常、この勾配はすべきではありません。 ただし、HCM では、左心室と大動脈の間に 50 ~ 150 mm Hg の圧力差があります。 Art.、最大 18 mm Hg までの左心室腔内の拡張末期圧の増加。 美術。 β遮断薬の導入後、圧力勾配は減少します。 また、心臓のサウンディング中に、造影剤が心室の空洞に注入され(心室造影)、その解剖学的特徴が研究されます。 多くの患者(原則として40歳以上の人)では、狭心症の病因を明らかにし、付随する冠動脈疾患を除外するために、心臓手術の前に冠動脈の血管造影(冠動脈造影)が同時に使用されます。 治療。 HCM の薬物治療の基本は、拡張期の心室への血流を改善する薬物です。これらの薬剤は、β 遮断薬のグループ (アナプリリン、アテノロール、メトプロロール、プロプラノロール、160 ~ 320 mg/日など) とカルシウム イオン拮抗薬のグループ (ベラパミル、ただし注意が必要) です。ノボキナミドとジソピラミドは心拍数を低下させ、抗不整脈効果もあります。治療の開始時には、これらの薬剤を少量から使用し、その後、患者が耐えられる最大量まで徐々に用量を増やしていきます。 β遮断薬は、真性糖尿病、気管支喘息、およびその他のいくつかの疾患では注意して使用されます. これらの薬で治療するときは、血圧と脈拍数を常に監視する必要があります。 圧力が 90/60 mm Hg を下回ると危険です。 美術。 心拍数が毎分 55 未満。 患者がβ遮断薬またはカルシウムイオン拮抗薬で治療できない危険なリズム障害を持っている場合、そのような患者の治療に他の抗不整脈薬が追加で使用されます. 抗凝固薬の予約は、発作性不整脈および心房細動、ならびに心腔内の血栓(ワルファリンなど)の存在下で推奨されます。 これらの薬による治療期間中、血液凝固系の多くの指標を定期的に監視する必要があります。 抗凝固剤の過剰摂取により、外出血(鼻、子宮など)および内出血(血腫など)が発生する可能性があります。 外科的治療は、内科的治療が効果的でない場合、または左心室と大動脈の間の勾配が 30 mm Hg を超える場合に、閉塞性 HCM 患者に行われます。 美術。 (筋切開術または筋切除術の手術が行われます-左心室の肥大した心筋の一部の切除または除去)。 僧帽弁置換と非外科的 IVS アブレーションも行われます。 予防。 HCM のすべての患者、特に閉塞型の患者は、短期間に身体活動を大幅に増加させる可能性のあるスポーツ (陸上競技、フットボール、ホッケー) を禁忌です。病気の予防は早期診断にあり、これにより病気の早期治療を開始し、重度の心筋肥大の発症を防ぐことができます。患者の遺伝的親戚において心エコー検査を行うことは必須です。年に一度の健康診断で行われる心電図やエコー検査も診断には重要です。閉塞性HCMの患者では、閉塞の存在がこの生命を脅かす状態を発症する条件を作り出すため、感染性心内膜炎を予防する必要があります(抗生物質による予防など)。 講義№4。心血管系の疾患。 拘束性心筋症 拘束型心筋症(RCMP) - (ラテン語のrestrictioから-「制限」)-心筋および心内膜の一連の疾患で、顕著な線維症と弾力性の喪失の結果として、さまざまな理由により、充填に一定の制限があります拡張期の心室の。 心室の充満は、初期充満の段階で行われ、続いて心室内圧が安定します。 この疾患には、心臓への不十分な血液供給が伴い、さらに慢性心不全の発症につながります。 拘束型心筋症は、すべての心筋症の中で最も研究が進んでおらず、最も一般的ではありません。 RCMPには、レフラーの壁側線維形成性心内膜炎(W. Loffler et al。、1936によって記述された温帯気候の国で発見)および心内膜線維症(D. Bedford et E. Konstmanによって記述された熱帯アフリカの国々で発見)が含まれます。 以前は、それらはXNUMXつの独立した病理学的プロセスと見なされていました。 ただし、これらの疾患の病理形態学的画像はほとんど異なりません。 RCMの原因。原発性 RCM は非常にまれであり、その発生原因として唯一証明されているのは、いわゆる好酸球増加症候群 (レフラー病、レフラー壁側線維形成性心内膜炎) です。主に30~40歳代の男性に発生します。好酸球増加症候群では、心内膜の炎症が起こり、時間が経つにつれて心内膜が著しく圧縮され、隣接する心筋と粗く癒着し、心筋の伸展性が急激に低下します。レフラー症候群は、6 か月以上持続する好酸球増加症 (1500 mm あたり 1 個の好酸球) も特徴とします。3)、内臓(肝臓、腎臓、肺、骨髄)への損傷。 ほとんどの場合、RCMP の起源は他の理由により二次的なものであり、その中で最も一般的なものは次のとおりです。 1) アミロイドーシス - 体内のタンパク質代謝の侵害に関連する疾患; 同時に、異常なタンパク質(アミロイド)が形成され、さまざまな臓器の組織に大量に沈着します。 心臓が損傷を受けると、アミロイドはその収縮性と伸張性を低下させます。 2)ヘモクロマトーシス - 体内の鉄代謝の違反であり、血液中の鉄分の増加を伴い、その過剰分は心筋を含む多くの臓器や組織に沈着し、それによってその伸展性の低下を引き起こします。 3) サルコイドーシス - 臓器や組織における細胞クラスター (肉芽腫) の形成を特徴とする原因不明の疾患。 肺、肝臓、リンパ節、脾臓が最も頻繁に影響を受けます。 心筋に肉芽腫が発生すると、その伸展性が低下します。 4)心内膜の著しい肥厚と圧迫があり、これも心筋の伸展性の急激な制限につながる心内膜疾患(心内膜線維症、心内膜線維弾性症など)。 特に心内膜の線維弾性症は乳児にのみ発生する可能性があります。 この病気は、重度の心不全が早期に発症するため、生命と両立しません。 病因。 RCM では、さまざまな理由で心筋コンプライアンスが低下します。その結果、心室の血液を満たす量が減少し、心室内圧が大幅に上昇します。ただし、HCMとは異なり、拘束型心筋症では代償性心筋肥大が発症する可能性は低いです。したがって、しばらくすると、肺循環に停滞が発生し、心臓のポンプ機能が低下し、それが徐々に体内の体液貯留、脚の持続的な腫れ、肝腫大、腹水の発症につながります。 心内膜の圧縮が房室弁(僧帽弁および三尖弁)にまで及ぶと、これは機能不全の発生によって悪化し、収縮性と伸張性の低下により心腔内の血栓症にもつながります。 これらの血栓の断片が血流とともに広がると、血栓塞栓症や大きな血管の閉塞、内臓の心臓発作を引き起こす可能性があります。 心筋の病理学的封入体が心臓の伝導系の領域に広がると、心臓インパルスの伝導にさまざまな障害が現れ、遮断の発生が伴います。 RCMPでは、さまざまなタイプの不整脈もかなり頻繁に観察されます。 上記に基づいて、病原性の観点からの病気は3つの段階で進行すると結論付けることができます。 ステージI - 壊死 - 心筋および他の臓器の好酸球浸潤。 ステージII-血栓性-左心室と右心室の空洞での血栓の形成、血栓塞栓性合併症の発症、および主に心尖部と房室弁の近くでの心内膜の段階的な肥厚。 III期-線維性で、心内膜が数ミリメートルまで肥厚することを特徴とし、心筋線維症が発現します-主に心内膜下領域。 組織化された血栓のために空洞が部分的に閉塞し、僧帽弁尖の線維化、僧帽弁逆流が認められる。 顕著な心房拡張。 拘束型拡張機能障害が観察されます。 臨床画像。この疾患の症状は非常に多様であり、小円または大円の循環障害の症状によって決まります(右心室または左心室の主な損傷に応じて)。 愁訴がない場合もあれば、肺循環または体循環のうっ血が原因である場合もあります。 患者は通常、運動中に最初に現れる息切れを訴え、病気が進行するにつれて、安静時に息切れが観察されます。 心臓のポンプ機能の低下により、患者は疲労と負荷に対する耐性の低下を訴えます。 時間が経つにつれて、足のむくみ、肝臓の肥大、腹部の水腫が加わります。 定期的に、不規則な心拍が現れ、持続的な遮断が発生すると、失神することがあります。 病気の発症の最初の段階(壊死)は、発熱、体重減少、咳、発疹、頻脈の出現を特徴としています。 診断法。 RCM を認識することは非常に困難です。多くの同様の疾患(アブラモフ・フィードラー型の特発性心筋炎、滲出性心膜炎、心臓弁膜症など)を除外した場合にのみ、この病態について自信を持って語ることができます。 RCMPの患者を診察すると、うっ血性心不全に特徴的な症状(浮腫、肝腫大、腹水)、および首の静脈の顕著な脈動が見られます。 後者は、心筋の拡張性が低いために心臓への血液供給が困難なためです。 聴診中、心臓の増加、収縮期後期の心雑音、および拡張期の心室の急速な充満による大きな初期III音の検出は非常に重要です。 心臓の心雑音は、房室弁不全の患者でも検出されます。 心電図検査では、心室心筋の中程度の肥大、心臓インパルスのさまざまなリズムおよび伝導障害、心電図上のT波の非特異的変化が明らかになりました。 心エコー検査は、病気を診断するための最も有益な方法の XNUMX つであり、心内膜の肥厚、心臓の心室を満たす性質の変化、心臓のポンプ機能の低下、急速な動きを明らかにします。拡張期の僧帽弁の前尖と、左心室の後壁の外側への急速な早期移動。 磁気共鳴画像法を使用すると、心臓の解剖学的構造に関する情報を取得し、心筋の病理学的封入体を特定し、心内膜の厚さを測定できます。 中枢血行動態のパラメータを調べると、両方の心室の充満圧の増加が決定され、左心室の最終圧力は右心室の圧力を上回ります。 心室造影は、左心室の収縮の増加、その壁の滑らかな輪郭を明らかにし、時には心尖部の充満欠損を伴う (閉塞の証拠)。 場合によっては、乳頭筋の領域のくぼみが決定されます。 弁不全、特に僧帽弁または三尖弁の徴候があります。 差動診断。 RCM の鑑別診断では、この疾患の外部症状と収縮性心膜炎との類似性を考慮することが非常に重要ですが、これらの疾患の治療法は正反対です。心筋および心内膜の生体内生検は通常、心臓プロービングと同時に使用され、これにより病気の性質を明らかにし、さらなる治療を行うためのより多くの情報が得られます。非常にまれなケースですが、上記の診断方法では RCM と収縮性心膜炎を区別できない場合は、手術台上で心膜の直接検査が行われます。 RCMP のすべての患者は、疾患の心臓以外の原因を特定するために、包括的な臨床的、生化学的および追加の検査を必要とします。 治療。病気の治療には大きな困難が伴います。心不全の治療に使用されるほとんどの薬剤は、疾患の特性により、心筋コンプライアンスを大幅に改善することが不可能であるため、望ましい結果が得られない可能性があります(場合によっては、カルシウムイオン拮抗薬が処方される場合があります)。これらの目的のため)。利尿薬(アルダクトン)は、体内の余分な水分を除去するために使用されます。持続的な伝導障害を解消するには、恒久的なペースメーカーの設置(植込み)が必要になる場合があります。 これは、サルコイドーシスやヘモクロマトーシスなどの疾患によって引き起こされ、二次RCMPの発症につながり、自己治療の対象となります。 サルコイドーシスの治療では、ホルモン剤(プレドニゾロンなど)が使用され、ヘモクロマトーシスの場合は、定期的な瀉血(体内の鉄濃度を下げるため)が使用されます。 心筋アミロイドーシスの治療は、その発生原因に直接依存しています。 心腔内の血栓症には抗凝固薬を使用することをお勧めします。 心内膜損傷によるRCMPの場合、外科的治療が行われます。 手術中、可能であれば、変化した心内膜の一部を切除します。 場合によっては、房室弁の機能不全がある場合、それらの補綴が行われます。 アミロイド心筋損傷の一部の形態は、心臓移植で治療されます。 RCMPの予防。残念ながら、この病気の予防策には限界があります。主に、アミロイドーシス、サルコイドーシス、ヘモクロマトーシスなどの予防可能な原因を早期に特定することが必要であり、これらの目標を達成するためには、毎年の国民健康診断が非常に重要です。 講義番号5。心血管系の病気。 感染性心内膜炎 感染性心内膜炎(IE) - 心臓の弁装置のポリポーシス - 潰瘍性病変(しばしば弁不全の発症を伴う)または壁側心内膜(それほど頻繁ではないが、大動脈または最も近い大動脈の内皮が影響を受ける)からなる疾患。 この疾患は、さまざまな病原性微生物によって引き起こされ、身体の反応性の変化を背景に、内臓(腎臓、肝臓、脾臓)の全身性病変を伴います。 これまで、さまざまな印刷物で、以前に使用されていた「細菌性心内膜炎」、「長引く敗血症性心内膜炎」という用語は、この病理学的プロセスを指すことがわかります。 しかし、細菌性病原体、リケッチア、ウイルス、真菌など、さまざまな微生物によって引き起こされる病気の原因をよりよく反映するのは、それらに取って代わった「感染性心内膜炎」という用語でした。 IEの患者数は世界中で増加しています。 これは、感染が病理学的に変化した場合により容易に発生するという事実の結果として、いわゆるリスクグループ(アテローム性動脈硬化症、リウマチ性、外傷性弁損傷、心臓または弁欠損、心室中隔欠損症、大動脈縮窄症の患者)の存在によるものです弁または心内膜。 病因。この病気の病原性原因物質は、ほとんどの場合、球菌群の微生物 - 連鎖球菌(ビリダンス連鎖球菌は症例の90%で以前に分離されていた)、ブドウ球菌(金色、白色)、腸球菌、肺炎球菌です。近年、抗生物質の普及により、微生物病原体の範囲が変化しています。この病気はグラム陰性菌(大腸菌、緑膿菌、プロテウス、クレブシエラ)によって引き起こされる可能性があり、病原性真菌、サルシナス、ブルセラ菌、ウイルスが重要な役割を果たしているという証拠が明らかになってきています。これらの病原体によって引き起こされる病気、特に真菌感染症によって引き起こされる心内膜炎(通常は抗生物質の不合理な使用によって起こります)はより重篤です。しかし、一部の患者では、病気の真の原因物質が検出されません(血液培養陰性率 20 ~ 50%)。 多くの場合、感染は人工弁の部位で発生します。これはいわゆる人工 IE で、主に心臓弁置換手術後 2 か月以内に発生します。 この場合、病気の原因物質は、ほとんどの場合、連鎖球菌の性質を持っています。 したがって、IEの感染源と細菌血症は非常に異なります(口腔内の手術、泌尿生殖器領域の手術と診断手順、心臓血管系への外科的介入(弁の交換を含む)、静脈内のカテーテルの長期滞在、頻繁な静脈内注入および内視鏡的研究方法、慢性血液透析(動静脈シャント)、静脈内薬物投与)。 無傷の弁で発生したいわゆる一次IE、および心臓とその弁装置の先天性および後天性変化を背景にしたIE、二次性心内膜炎があります。 これらの変更により、患者を別々のリスクグループに区別することが可能になります:心臓欠陥(先天性および後天性)、僧帽弁逸脱、動静脈動脈瘤、梗塞後動脈瘤、シャント、心臓および大血管の手術後の状態。 病因。 IEの発症メカニズムは複雑で十分に研究されていませんが、病気の発症における主要なポイントは特定できています。 免疫反応、さまざまな内因性および外因性の要因の転覆を伴う体液性および局所(細胞)免疫の変化の影響下で体内に感染の焦点がある場合、細菌血症が発症します。 血液から微生物が心臓弁に入り、そこで感染の二次的な焦点を作ります。 心内膜への微生物の固定と繁殖は、多くの要因によって促進されます。弁の組織と表面の以前の変化、血流の直接的な損傷効果の影響下で発生する血栓性の塊の存在。その心臓内循環が既存の心臓病の状態で変化するとき。 同時に、さまざまな血球(血小板など)が外傷部位に「接着」し、弁からぶら下がっているつららに似た細胞増殖を形成します。 これらの植物は、血管床に入った感染に利用できるようになります。 大きな圧力勾配の発生による弁の変形、穴の狭さ、および血流速度の変化もまた、感染性の焦点の形成を伴う心内膜への感染性物質の導入に寄与する。 以前は無傷の弁が損傷すると、この弁の個々のセクションの正常な特性を破壊する変化が起こり(腫れが現れます)、滲出または増殖プロセス(「間質性弁膜炎」 - 前臨床段階)。 病気の発症において、ステージIIIを区別することができます。 ステージ I (感染性 - 毒性) は、さまざまなレベルの中毒で進行します。 バクテリアの増殖、弁の破壊があり、心臓病の発症につながります。 同じ段階で、感染の血行性拡散のためにプロセスの一般化がしばしば起こります - 弁尖の断片または微生物のコロニーが弁から分離することができ、尖が破裂する可能性があります。 弁微生物植生の断片の剥離は、血管床のさまざまな部分への感染した塞栓の導入に寄与し、敗血症の症状を悪化させます。 弁の破片または微生物植生は、血流とともに体内を循環し、脳に入ると脳梗塞を引き起こし、麻痺、麻痺、およびその他のさまざまな神経障害を伴います。 破壊された弁はその機能を果たすことができず、すぐに心不全が急速に進行します。 ステージII-免疫炎症性。弁に固定された微生物が、長期の自己感作と体の臓器や組織への高作動性損傷を引き起こします(プロセスの免疫一般化)。 この期間中、免疫複合体は血液中を循環し、組織(心臓、腎臓、肝臓、血管)に固定されます。 免疫障害および自己免疫疾患は、血管炎および内臓炎(免疫複合体腎炎、心筋炎、肝炎、毛細血管炎など)の発症を引き起こします。 ステージIII - ジストロフィー - 病理学的プロセスの進行とともに発生します。多くの臓器の機能が妨げられ、心不全と腎不全が発生し、病気の経過がさらに悪化します。 分類。現在、IE の分類と命名法は、臨床形態、経過変化、活動性の程度、病因段階、疾患の臨床形態および形態学的形態を反映して使用されています (表 6 を参照)。 表6 IEの分類
また、アクティブなIEと非アクティブな(修復された)IEも区別されます。 それらが区別する外科的分類もあります: 1)病変は弁尖に限定されます。 2) 病変が弁を越えて広がっている。 急性 IE (急速に進行し、8 ~ 10 週間かけて発症する) はまれであり、通常は以前に心臓病にかかったことがなく、一般的な敗血症の画像によって臨床的に明らかになります。 現代の治療法では、それを亜急性に変えることができます。 亜急性 IE (最も一般的) は 3 ~ 4 か月続き、適切な薬物療法により、寛解が生じることがあります。 ただし、病気が再発する可能性があります。 長期のIEは、悪化と寛解の期間を伴って何ヶ月も続き、軽度の臨床症状、軽微な検査パラメーター、および一般的な障害を特徴とします。 この病気は通常、治療によく反応します。 好ましくない経過では、重度の合併症が発生し、患者は進行性心不全で死亡し、敗血症中毒が増加します。 臨床画像。感染の原因物質に応じて、IE は突然発生して急速に進行する場合 (黄色ブドウ球菌、腸球菌)、または潜在的に発症する場合 (ウイルス連鎖球菌) があります。 IEの症状は症候群の形で現れます。 1)炎症性変化および敗血症の症候群(発熱、悪寒、出血性発疹、急性期の血液パラメータの変化:左へのシフトを伴う白血球増多、ESRの増加、C反応性タンパク質の出現、フィブリノーゲンの増加、α2-グロブリン。 2)体の一般的な中毒の症候群(脱力感、発汗、頭痛、筋肉痛および関節痛、食欲不振、発作性の色合いを伴う皮膚の蒼白)。 3)弁損傷症候群(心臓病の形成)。 4)「実験室」免疫障害の症候群(血液中を循環するか、腎臓、心筋、血管に固定される免疫複合体の存在;高ガンマグロブリン血症;リウマチ因子の出現;抗組織抗体の検出)。 5)血栓塞栓性合併症の症候群(限局性腎炎、心筋梗塞、脾臓、腸、脳の血栓塞栓症、下肢の血管など)。 6)病変の汎発性症候群(びまん性糸球体腎炎、心筋炎、肝炎、血管炎など)。 これらの症候群の重症度は異なります。 それは、IEの経過の性質、段階、病原体の種類によって異なります。 たとえば、ブドウ球菌性IEは、プロセスの高活性、一般的な中毒の重度の症状、および化膿性合併症の発症を特徴としています。 真菌性心内膜炎は通常、太い動脈、特に下肢の塞栓性閉塞を伴います。 この疾患の典型的な図は、ストレプトコッカス ビリダンスによって引き起こされる IE の特徴です。 疾患の発症は、多くの場合、急性感染症または慢性感染症の悪化、および多くの医療処置に関連しています。 特に特徴的なのは、さまざまな程度の体温の上昇 (長引く発熱から亜熱状態または平熱まで) と悪寒および発汗の組み合わせです。 患者は、感染プロセスと中毒の存在、および心臓損傷の血栓塞栓性合併症の存在による同時の苦情を示します。 患者には、長期の抗生物質治療のエピソードの病歴がある場合があります (これは、以前に治療を受けた患者で IE が再発した場合に発生します)。 診断法。正しい診断を行うために最も重要なことは、既存の心臓欠陥の聴診パターンの変化によって心臓弁の損傷を検出することです。 「追加の」ノイズの出現。皮膚および粘膜の特徴的な病変が明らかになります。カフェオレ状の皮膚の色、出血、陽性ヘクト病(つまむ症状)およびコンチャロフスキー・ルンペル・リーデ(止血帯)症状、ならびにオスラー結節(手掌表面の痛みを伴う充血性の高密度結節)、および指先 、ルーキン・リブマン徴候(ルーキン・スポット) - 結膜の移行期のひだの出血。 IEでは脾腫がよく観察されます。大幅な体重減少(場合によっては 15 ~ 20 kg)が非常に典型的です。まれに、心膜炎が発生することがあります(心膜上の線維性沈着によって引き起こされるかすかな胸膜摩擦音)。身体検査により、びまん性糸球体腎炎の発症を示す血圧の上昇が明らかになる場合があります。場合によっては、脳血管の塞栓症の結果として中枢神経系の機能不全の兆候(麻痺、運動亢進、病理学的反射など)が判明することがあります。 この場合、最も一般的な診断エラーは、独立した疾患の徴候としての特定の症候群の評価です(たとえば、肝障害の顕著な兆候、肝炎の診断など)。 ただし、IE の診断は、主に病気の原因物質の早期発見に基づいています。 このために、次の実験室および機器研究が使用されます。 1)陽性の血液培養を取得することは、IEの最も重要な診断サインです。 この場合、最も効果的な抗生物質を選択するための分析も必要です。 診断を確定するには、少なくとも2〜3個必要です。 非常に重要なのは、採血と培養の技術、接種の時期(できれば発熱の高さ)、濃縮培地の使用です。 2) NBT (ニトロブルットテトラゾリウム検査) の実施 - 細菌感染症を他の炎症性疾患と区別することを可能にする全身性細菌感染症の診断。 この方法は、好中球による可溶性 NBT 色素の不溶性ホルマザン沈殿物への還元に基づいています。 NBT 陽性細胞の数が 10% を超える場合、テストは陽性と見なされます。 3)急性期指標を検出するための臨床血液検査:50 mm / h以上へのESRの増加、白血球式の左へのシフトを伴う白血球増加症、または(ステージIIでは)白血球減少症および低色素性貧血を検出できます。 診断値は、耳たぶから採取した血液中の組織球の検出に添付されています。 視野内に 6 を超えるそれらのコンテンツは、IE に有利であることを示している可能性があります。 生化学的血液検査は、フィブリノーゲン、αの含有量の増加を示しています2-グロブリンとα-グロブリン - 最大30〜40%。 4) 免疫学的変化の同定: 高ガンマグロブリン血症、循環免疫複合体、補体力価の低下、リウマチ (抗グロブリン) 因子の出現、PHA (フィトヘマグルチニン) および細菌抗原によるリンパ球の激しい形質転換の反応の増加、抗組織抗体の検出。 5)尿検査は、タンパク尿、円柱尿症、血尿を呈する糸球体腎炎が検出された場合に、さまざまな臓器やシステムの病変を明らかにするために行われます。 ビリルビン、トランスアミナーゼの含有量の増加は、肝障害を示します。 6) IE の直接的な診断サイン - 心臓弁の植生の存在 - は、心エコー検査によって検出されます。 したがって、さまざまな症状の中から、主な症状と追加の症状を区別する必要があります。 IEの診断の主な基準: 1)悪寒を伴う38°Cを超える温度の発熱; 2)ルーキンスポット; 3) オスラー結節; 4)未変化の弁(一次)またはリウマチ性および先天性心疾患の背景に対する心内膜炎。 感染性心筋炎; 5)多発性動脈血栓塞栓症、出血を伴う真菌性動脈瘤の破裂。 6) 脾腫; 7) 陽性の血液培養; 8)抗生物質の使用による顕著なプラスの効果。 IEの診断のための追加基準: 1)体温が38°Cまで上昇し、冷える。 2)皮膚の出血; 3)急激な体重減少; 4)手、足の小さな関節の非対称性関節炎; 5) 貧血; 6) 40 mm/h を超える ESR; 7)急激に正のSRV。 8) リウマチ因子の存在; 9) 25%以上のα-グロブリン; 10) 免疫グロブリンM、E、およびAの含有量の増加。 差動診断。血栓塞栓症はIEで最も頻繁に観察されますが、体循環の動脈における塞栓症の他の原因を除外すべきではありません:経壁性心筋梗塞および心臓動脈瘤、特発性アブラモフ・フィードラー心筋炎およびさまざまな原因による心房細動ですが、主にリウマチ性狭窄で観察されます。左房室開口部の。 リウマチ性および感染性心内膜炎は、鑑別診断にとって最も重要です (表 7)。 表7 リウマチ性心内膜炎と長期IEの鑑別診断基準
IEの特徴的な症状には、脾臓の肥大が含まれます。 しかし、アミロイドーシスでは大きくて硬くて無痛の脾臓が見られます。 柔らかく、無痛は、その敗血症性過形成を示します。 痛みは、被膜下に位置する脾臓の梗塞で認められます。 脾腫は、右心不全における門脈圧亢進症の症状の XNUMX つかもしれません。 この場合、それは腹水および肝腫大と組み合わされます。 長期のIEに伴う肝臓のサイズの増加は、非常に頻繁に観察されます。 敗血症性過形成は、肝臓の比較的小さな肥大と軟らかい硬さを特徴としています。 脂肪変性があり、ごくまれに肝梗塞があります。 ほとんどの場合、肝臓の増加は、右心不全を伴う静脈うっ血に関連しています。 腹水がない場合、うっ血は、強心配糖体および利尿薬による治療後の肝臓サイズの減少によって遡及的に認識されます。 治療。 IEの治療は、細菌学的データを考慮して、できるだけ早期に、かつ不定向性で行う必要があります。抗菌薬が医療現場で広く使用されるようになる前は、IE 患者のほとんどが感染症とその合併症で死亡していました。現在では80%以上が治癒に成功しています。しかし、20%近くの人は薬物治療が失敗し、すぐに治療がほぼ不可能な心不全を発症します。この点に関しては、保存的治療と外科的治療を組み合わせることをお勧めします。 あらゆる年齢層のIEの治療には、主に微生物に殺菌効果のある抗生物質が使用されます。血液中の抗生物質の濃度と病原体の感受性に応じて、個別の用量が望ましいです。 最初に選択する薬はまだペニシリンです。 毒性が低く、比較的高用量で長期間使用できます。 20日量-最大000IUが静脈内および筋肉内に投与されます。 しかし、高齢者や老人患者では、ペニシリンや他の抗生物質を高用量で治療すると、心不全の出現や激化、心臓の痛み、頻脈などの心毒性効果がしばしば観察されるという事実を排除するべきではありません。 用量を減らすか、薬を変えると、これらの現象は止まります。 病因は不明ですが、治療は、筋肉内または静脈内に最大18〜000単位以上の高用量のベンジルペニシリン、000日あたり最大20 g / mのストレプトマイシンまたはアミノグリコシド(ゲンタマイシン、トブラマイシン000〜000 mgの割合)との組み合わせで始まります。 /日)が使用されます。1日あたりのkg)。 効果がない場合、または病原体を特定した後、半合成ペニシリンが使用されます(オキサシリン、メチシリン、またはアンピシリンの筋肉内投与は最大4g /日)。 セファロスポリンは、IEの治療に使用される基本的な薬でもあります。最も一般的に使用されるのは、クラフォラン、セファミシン(6〜12 g /日、筋肉内および静脈内)、ゼポリン(4〜10 g /日)、ケフゾール(最大静脈内に10-16g)など)。 フシジンは優れた抗ブドウ球菌効果があり、場合によっては他の抗生物質に対する微生物の耐性に効果的です(8〜10g /日)。 抗生物質治療は、感染が完全になくなるまで、1,5〜2か月のコースで長期間処方されます。 感染の排除後、患者の全身状態は改善し、心エコー検査および微生物学的確認に従って植生は消失します。 生物の免疫反応性が低下すると、免疫調節剤(チマリン、T-アクチビンなど)を使用して、抗菌剤が受動免疫療法(たとえば、ブドウ球菌性心内膜炎-抗ブドウ球菌血漿または抗ブドウ球菌α-グロブリン)と組み合わされます。 例えば、血管新生性敗血症を背景に発症した心内膜炎による血栓症の予防のために、ヘパリン(20-000 IUの静脈内または皮下)を使用して制御された低凝固が作成されます。 タンパク質分解酵素の阻害には、コントリカルが使用されます(静脈内に最大25〜000 IU)。 弁膜性IEが心臓弁膜症の形成に寄与した場合、または大量の抗生物質療法にもかかわらず疾患の症状が消えない場合は、外科的治療を行うことをお勧めします. 外科的介入を支持する追加の議論は、感染によって破壊された心臓弁葉からの塞栓症の繰り返しです。 感染が弁輪の境界を越えて膿瘍を形成することもあり、これは外科的治療の兆候でもあります。 手術の主な目的は、患者自身の弁を保存することです。 植生の除去、弁の縫合破裂などに限定される場合もあります。感染の影響で弁がほぼ完全に破壊された場合、機械的および生物学的補綴物を使用して人工弁(補綴物)に置き換えられます。 予防。 IEの予防は、口腔、扁桃腺、鼻咽頭、副鼻腔の慢性感染巣の適時な衛生管理と、急性連鎖球菌性およびブドウ球菌性疾患(狭心症など)に対する積極的な抗菌療法の使用で構成されます。ボディを固めるのがおすすめです。 心臓弁膜症および人工弁を使用しているすべての患者は、感染症が血流に入る可能性がある介入の前日と直後に抗生物質を予防的に服用する必要があります。 急性レンサ球菌、ブドウ球菌感染症にかかった人の診療所での観察が必要です。 講義番号6。呼吸器系の病気。 気管支ぜんそく 喘息の完全な定義は今日まで存在しませんが、この疾患の最も完全な定義は 1982 年に G. B. Fedoseev によって与えられました。その主要かつ必須の病原性メカニズムは、特異的(免疫学的)および(または)非特異的、先天的または後天的メカニズムによる気管支反応性の変化であり、主要な(必須の)臨床徴候は喘息発作および(または)喘息発作です。気管支平滑筋のけいれん、分泌過多、分泌障害、気管支粘膜の浮腫による状態(喘息状態)。 病因。喘息の発生には、いくつかの要因の組み合わせが重要な役割を果たします。この点に関して、喘息にはアトピー性(ラテン語のアトピアから「遺伝的素因」)と感染性アレルギーの2つの形態があります。遺伝的素因は、特定の組織適合性抗原 (HLA) と喘息の重症度との関連によるものであり、喘息の重症度の増加は特に B 抗原保有者でよく観察されます。35 B40. 疾患の発症の内部要因は、免疫、内分泌系、自律神経系、気管支の感受性と反応性、粘膜繊毛クリアランス、肺血管内皮、迅速な応答系(マスト細胞など)、アラキドン酸代謝などの生物学的欠陥です。 。 外部要因は次のとおりです。 1)感染性アレルゲン(ウイルス、細菌、真菌、酵母など); 2)非感染性アレルゲン(花粉、ほこり、工業用、医薬品、食品、マダニ、昆虫、動物のアレルゲン); 3) 機械的および化学的刺激物 (金属、木材、ケイ酸塩、綿粉、酸、アルカリの蒸気、煙など); 4)気象学的および物理化学的要因(気温と湿度の変化、気圧の変動、地球の磁場、物理的な努力など); 5)ストレスの多い神経精神的影響と身体活動。 感染性病原体は、アレルゲン効果をもたらすだけでなく、非感染性(アトピー)アレルゲンに対する体の感受性閾値を低下させ、それらの呼吸粘膜の透過性を高めます。 標的細胞(肥満細胞、好塩基球、単球など)とエフェクターシステムの反応性に変化をもたらします。 病因。気管支の反応性の変化は病気の発症の中心的な関係であり、一次性または二次性の可能性があります。前者の場合、反応性の変化は先天的なもの、または化学的、機械的、物理的要因や感染症への直接曝露によって後天的に起こる可能性があります。気管支の反応性の二次的な変化は、体の免疫系、内分泌系、および神経系の反応性の変化の現れです。したがって、AD の病因について言えば、免疫学的メカニズムと非免疫学的メカニズムという 2 つのグループのメカニズムを区別することができます。 大多数の場合の免疫学的メカニズムは、病気の過程で支配的です。 過敏反応のタイプI、III、およびIVに従って発生する、すなわち体液性および細胞性免疫の変化を伴う、気道の粘膜における免疫担当システムの違反は、気管支反応性の変化をもたらす。 同時に、分泌型IgAが減少し、食作用システムが破壊され、リンパ球のTサプレッサー機能が低下し、インターフェロンの産生が低下し、最終的には体の抗ウイルス防御が低下します。 タイプI(アトピー、リージニック、またはアナフィラキシー)。 エキソアレルゲン抗原(花粉、動植物タンパク質、細菌、薬物)の体内への摂取に応じて、IgE(領域)の産生が増加し、肥満細胞(一次エフェクター細胞)に固定されて蓄積します。 これはADの免疫学的段階です。 これに続いて、プロセスの病化学的段階が進行します-血管作用性、気管支痙攣性および走化性物質(ヒスタミン、セロトニン、さまざまな走化性因子など)の放出を伴う肥満細胞の脱顆粒。 これらは、血管および標的細胞(二次エフェクター細胞)に作用する一次メディエーターです-好酸球、好中球、血小板、マクロファージ単球。 後者は、一次メディエーターにさらされると、二次メディエーター(ロイコトリエン、プロスタグランジン、トロンボキサン、血小板活性化因子、およびエイコサノイドのグループに属する他の物質)を分泌します。 生物活性物質の影響下で、病因の病態生理学的段階が始まります。微小循環床の透過性が高まり、浮腫、漿液性炎症、および気管支痙攣の発症につながります。 臨床的には、これは気管支の開存性の急激な侵害と喘息発作の発症によって明らかになります。 III型反応(免疫複合体型、またはアルサス現象)は、エキソアレルゲンおよびエンドアレルゲン(感染性またはアレルギー性炎症およびさまざまな刺激物の作用の結果としての細気管支および肺胞のタンパク質の変性によって形成される自己アレルゲン)の影響下で発生します。 この反応は、クラスOおよびMの免疫グロブリンに属する沈殿抗体の関与により、過剰な抗原のゾーンで発生します。形成された抗原抗体複合体の損傷効果は、補体活性化、リソソーム酵素の放出によって実現されます。 基底膜の損傷、気管支の平滑筋のけいれん、血管拡張があり、微小血管系の透過性が増加します。 IV型(細胞性、遅延型過敏症)は、感作されたリンパ球が有害な影響を与えるという事実によって特徴付けられます。 この場合、アレルギー反応のメディエーターは、リンホカイン(マクロファージ、上皮細胞に作用する)、リソソーム酵素、および活性化キニンシステムです。 これらの物質の影響下で、浮腫が発生し、粘膜の腫れ、気管支痙攣、粘性のある気管支分泌物の過剰産生が起こります。 その結果、窒息の発作によって現れる気管支の開存性の急性違反が起こります。 非免疫学的メカニズムは、先天性および後天性の生物学的欠陥の結果としての気管支反応性の主要な変化です。 非免疫学的メカニズムは、一次または二次エフェクター細胞、または気管支の平滑筋、血管、気管支腺の細胞の受容体に作用します。 これは、標的細胞、とりわけ肥満細胞の反応性を変化させ、生物学的に活性な物質(ヒスタミン、ロイコトリエンなど)の過剰な産生を伴います。 それらの放出に応答して、気管支痙攣、粘膜の腫れ、気管支腺の過敏症および椎間板炎が発症する。 これらすべてが気管支の開存性を劇的に変化させ、喘息発作を引き起こします。 気管支抵抗は、反射として条件付きおよび無条件に変化する可能性があります。たとえば、冷たい空気への曝露、刺激性のガスや塵の吸入、身体活動によって生じる閉塞は、迷走神経反射による気管支けいれんによって引き起こされます。気管支けいれんの原因は、迷走神経の気管支収縮反射のエフェクターゾーンへの損傷や、β-アドレナリン受容体の遮断であることもあります。 最近、彼らは、グルココルチコイド不全および排卵障害の気管支開存性の違反の病因における特別な役割について話している. グルココルチコステロイドの不足は、マスト細胞の過敏性の発症、カテコールアミンの合成の減少、およびプロスタグランジン F の活性化につながります。2a、および免疫担当システムの違反(ここでは、ADの病因および免疫学的および非免疫学的メカニズムへの複雑な関与について説明します)。 高エストロゲン血症および低プロゲステロン血症は、α-およびβ-アドレナリン受容体に作用し、前者の活性を高め、後者の活性を低下させます。 分類。喘息の病因における 1982 つまたは別のメカニズムの優位性により、喘息のさまざまな病因的特徴を特定することができます。現在、G. B. Fedoseev (XNUMX) によって提案された分類が使用されています。 AD 開発の段階。 I - 喘息前(発達を脅かす状態:急性および慢性気管支炎、気管支痙攣の要素を伴う急性および慢性肺炎、血管運動性鼻炎、蕁麻疹)。 II - 臨床的に形成された BA (最初の発作後または喘息状態の即時発症後と見なされる)。 BA フォーム: 1)免疫学的; 2)非免疫学的。 ADの病因メカニズム(臨床的および病的バリアント): 1) アトピー; 2) 感染に依存。 3) 自己免疫; 4) 不調和; 5)神経精神的不均衡; 6)アドレナリン作動性の不均衡; 7) コリン作動性の不均衡; 8)一次変化した気管支反応性。 XNUMX人の患者では、いくつかの臨床的および病的バリアントの組み合わせが可能です。 このような状況では、検査時に、この患者の主なバリアントを強調する必要があります。これは、適切な治療にとって重要です。 BAの長いコースの過程で、病原性メカニズムの変化が可能です。 BA の重大度: 1)軽度の経過(悪化はまれで、年に2〜3回、さまざまな気管支拡張薬を服用することで短期の喘息発作が止まります); 2)中等度の重症度(年に3〜4回のより頻繁な悪化、喘息発作はより重症であり、薬物の注射によって止められます); 3)重度の経過(頻繁かつ長期の悪化、重度の発作、しばしば喘息状態に変わることを特徴とする)。 コースの厳しさによるBAの分割は条件付きです。 したがって、軽度のBAの経過では、患者は突然発症した喘息発作で死亡する可能性があります. BAコースの段階: 1) 増悪 (喘息または喘息状態の再発発作の存在); 2)悪化の沈静化(発作はよりまれで軽度になり、病気の身体的および機能的徴候は悪化段階よりも顕著ではなくなります); 3)寛解(喘息の典型的な症状が消える:喘息発作は起こらない;気管支の開存性は完全にまたは部分的に回復する)。 合併症: 1)肺:気腫、肺不全、無気肺、気胸、喘息重積症など。 2)肺外結核:肺性心(右心不全の発症により代償不全および代償不全)、心筋ジストロフィーなど。 臨床画像。喘息の最も特徴的な兆候は、窒息の発作(主に呼気時の呼吸困難)、息切れ、およびさまざまな種類の咳(空咳、発作性咳嗽、または粘稠な痰の放出を伴う咳)の訴えです。気管支肺感染症が発症すると、体温の上昇が引き起こされます。その結果生じる鼻呼吸困難は、アレルギー性鼻副鼻腔炎(血管運動性鼻炎、ポリポーシス)の症状であり、通常は喘息の前段階に発生します。 履歴データは、発作の発症と特定のアレルゲンおよび他の要因への曝露との間の関係を確立するのに役立ちます。 ほとんどの場合、それは気道の感染症であり、特に病気の悪化においてです。 既往歴から、彼らは身体的努力(早歩き、笑いなど)、気象要因の変化(寒さ、高湿度など)、分娩異常、専門的要因が喘息の発生に及ぼす影響について学びます。攻撃します。 アレルギー歴の研究は、BA のアトピー性バリアントの診断に役立ちます。 そのような場合、病気の悪化は季節性であり(より頻繁に春と夏に)、鼻炎、結膜炎を伴います。 そのような患者には蕁麻疹、クインケ浮腫があります。 食物不耐症、多くの医薬品が検出されています。 アレルギー疾患に対する遺伝的素因があります。 既往歴からのデータは、しばしばいわゆるアスピリン喘息の存在を確立することを可能にします. この場合、遺伝性のアレルギー疾患はありません。 そのような患者は、鼻呼吸の障害(ポリープの成長)を心配しており、最も特徴的な症状は、喘息発作を引き起こす非ステロイド性抗炎症薬(アセチルサリチル酸、インドメタシンなど)に対する不耐性です。 この場合、ADのプロスタグランジンメカニズムを想定することはすでに可能です。 過去の喘息状態の発生に関するデータは、疾患の経過の重症度を示し、コルチコステロイド療法の必要性を示しています。 診断法。非常に重要なのは、アレルギーの肺外症状、気管支閉塞の兆候、喘息の合併症、および気管支けいれん発作を伴うその他の疾患を特定することです。 皮膚を調べると、蕁麻疹、BAの免疫学的変異体を示す丘疹性紅斑性発疹などのアレルギー症状が検出されます。 喘息と湿疹、神経皮膚炎、乾癬の組み合わせは、重度の喘息の素因となります。 多くの場合、鼻呼吸の違反を特定することが可能です。 鼻炎およびポリープは、喘息前と見なされます。 副鼻腔炎および他の副鼻腔炎は窒息を引き起こす可能性があります。 多くの場合、根底にある慢性気管支炎が原因である肺の身体検査は、慢性呼吸不全および肺性心の発症につながる肺気腫の兆候を明らかにする可能性があります。 気管支閉塞の聴診徴候が検出されます:呼吸の変化(長い呼気、乾いた、ほとんどが喘鳴、喘鳴)、強制呼気、潜在的な気管支痙攣(出現または乾いた喘鳴の増加)を明らかにします。 肺の聴診は、患者が横になっている位置で実行する必要があります。乾いたラ音の数は、「迷走」メカニズムで増加します。 特定の領域で絶えず耳を傾けていると、湿った声 (「パチパチ」) の細かい泡立つラ音が発生した場合、肺硬化症が発生している可能性があります。 患者の客観的な検査により、他の病気の症状が明らかになります(顔の皮膚の「蝶」、肝臓と脾臓の増加を伴うリンパ節腫脹、血圧の持続的な上昇、持続的な発熱など)。気管支痙攣の発作が起こり、窒息(全身性エリテマトーデス、結節性動脈周囲炎)によって明らかになります。 その後、AD の疑いのある診断の可能性は低くなります。 スピログラフは、閉塞性気管支閉塞の特徴的な兆候を明らかにします:最初の1秒間の強制呼気量の減少(FEVXNUMX)、ティフノ係数の減少(FEV1 割合として VC に) と FEV の割合1 FZhELへ。 BA の増悪時には、残肺気量 (RLV) と機能的残気量 (FOC) が初期レベルを 100% 以上超えます。 スパイログラムを分析すると、スピログラムの下降色の上部にノッチが存在することにより、気管気管支ジスキネジアの兆候が見られ、気管支の開存性の違反に寄与します(コルベット・ウィス症候群)。 ニューモタコメトリは、気管支閉塞の特徴である呼気力に対する吸気力の優位性を示しています。 流量曲線の構築を伴うニューモタコグラフィーによれば、気管支開存性の違反は、大、中、および小気管支のレベルで別々に診断されます。 身体活動、冷気、刺激性ガス、およびアセチルコリンの吸入に応答して、スピログラフィー、ニューモタコメトリー、およびニューモタコグラフィーを使用して記録された気管支抵抗の増加の出現は、気管支反応性の変化を示しています。 アレルギー検査は、さまざまな非感染性および感染性アレルゲンのセットを使用して実行され、病気の悪化以外でのみ実行されます。 アレルゲンの誘発効果を評価するために、皮膚アレルギー試験が実施され(アレルゲンの適用、乱切および皮内法)、アレルゲンは眼の結膜、鼻粘膜に適用されます。 最も信頼できるのは喘息の特定の診断です - 吸入誘発試験の助けを借りて特定の気管支過敏症を特定します。 しかし、この投与経路が重度の喘息発作または喘息重積症の発症を引き起こす可能性があるという事実を見失ってはなりません。 ADの特定の診断のために、例えば、アレルギー検査を行うことが不可能な場合、IgE抗体を定量化することを可能にする放射性免疫吸着検査も使用されます。 臨床検査は、提案された診断を確認し、病気の進展と治療の有効性を評価するのに役立ちます。 喘息の主な診断基準は、喀痰中の好酸球の出現ですが、これは非特異的な症状であり、身体の一般的なアレルギー反応の徴候として役立つ可能性があります。 喀痰中のクルシュマンらせんとシャルコー・ライデン結晶の検出も診断的価値があります。 実験室での研究は、活発な炎症プロセスの存在と、急性期指標の増加という観点からのその重症度の程度を証明しています。 喘息の増悪と喘息状態の場合の呼吸不全の増加に伴い、酸塩基状態と血液ガス組成を研究することが重要です。 X線検査は、感染の病巣(副鼻腔、歯、胆嚢)、および肺の急性(肺炎)または慢性炎症過程の悪化、肺気腫および肺硬化症の存在を診断します。 ECGデータは、代償性肺性心 - 右心肥大 - の発症の兆候を証明しています。 差動診断。 BA は心臓喘息とは区別されます (表 8 を参照)。 表8 ADの鑑別診断
感染性アレルギー性喘息とアトピー性喘息を区別することも必要です(表9を参照)。 表9 感染性アレルギーおよびアトピー性喘息
治療。喘息の治療では、段階的なアプローチが推奨されますが、これは、同じ患者でも、人によって経過の重症度が異なることで説明されます。ステージ 1 は最も軽度の喘息であり、ステージ 4 は最も重度です。 ステップ 1: 喘息の症状が引き金 (花粉や動物の毛など) への曝露や運動によって現れる軽度の間欠的経過。 そのような患者の治療における抗炎症薬の長期使用は示されていません。 治療は、必要に応じて予防薬(吸入β2アゴニスト、クロモグリク酸、ネドクロミル、または抗コリン作用薬)。 時折、より重篤で長期にわたる悪化には、短期間の経口コルチコステロイドが必要です。 喘息がより頻繁な症状、気管支拡張薬の必要性の増加を伴って現れる場合は、次の段階に進む必要があります。 ステージ 2. やや持続的なコース。 一次治療には、抗炎症薬、吸入コルチコステロイド、クロモグリク酸ナトリウム、またはネドクロミル ナトリウムが含まれます。 コルチコステロイドの投与量は、200 日あたり 500 ~ XNUMX マイクログラムのジプロピオン酸ベクロメタゾンまたはブデソニドです。 対症療法、吸入β2-アゴニスト、ただし3日4〜750回以下。 より重篤で長期にわたる悪化については、経口コルチコステロイドの短期コースが与えられます。 吸入コルチコステロイドの初回投与にもかかわらず症状が続く場合は、ジプロピオン酸ベクロメタゾンの投与量を800日あたり500〜XNUMXマイクログラムに増やす必要があります。 しかし、特に喘息の夜間発作を制御するために、吸入ホルモンの投与量を増やす代わりに、夜間に服用する長時間作用型気管支拡張薬を追加することもできます(少なくともXNUMXmcgの吸入コルチコステロイドの投与量で)。 ステージ 3 は、BA の中等度の重症度が特徴です。 そのような患者は、予防的抗炎症薬を毎日摂取する必要があります。 吸入コルチコステロイドの用量は、長時間作用型気管支拡張剤と組み合わせて800〜2000 mcgです。 長時間作用型テオフィリン(5〜15 µg / ml以下の濃度を常に監視)、経口および吸入βを使用できます2長時間作用型アゴニスト。 症候的にβを指定する2-短時間作用型アゴニストまたは代替薬(ステージ2)。 ステージ 4. 完全にコントロールされていない重度の喘息。 この場合、治療の目標は可能な限り最良の結果を達成することです。 一次治療には、長時間作用型気管支拡張薬と組み合わせた高用量の吸入コルチコステロイド (800 日あたり 2000 ~ XNUMX マイクログラムのジプロピオン酸ベクロメタゾン) が含まれます。 必要に応じてβ吸入を行い、症状を緩和します。2- 短時間作用型アゴニスト (3 日 4 ~ XNUMX 回以下)。 より深刻な増悪には、経口コルチコステロイドによる一連の治療が必要になる場合があります。これは、最小限の用量または隔日で処方されます。 副作用の発生を防ぐために、高用量の吸入コルチコステロイドがスペーサーを介して投与されます。 ステップ 5 では、支持療法を減らします。 これは、喘息が少なくとも3か月間コントロールされている場合に可能であり、これにより副作用のリスクが軽減され、計画された治療に対する患者の感受性が高まります. 治療の「軽減」は、最後の投与量または追加の薬物を徐々に減らす(キャンセルする)ことにより、症状、臨床症状、および呼吸機能の指標を常に制御しながら行われます。 攻撃を阻止する。軽度の発作は、短時間作用型の気管支拡張薬を使用して自宅で治療できます。症状が完全に消えるまで治療が行われます。中等度および重度の発作には、適切な用量の短時間作用型気管支拡張薬(吸入β2-短時間作用型アゴニスト)だけでなく、全身性コルチコステロイドの任命。 患者が低酸素血症を患っている場合は、酸素を投与する必要があります。 医療センターや病院での喘息発作の治療には、高用量の吸入β2ネブライザーを介してアゴニスト。 スペーサーを介した定量エアロゾル吸入器の使用は非常に効果的です。 好ましくは、コルチコステロイドは静脈内ではなく経口投与される。 高用量のβと組み合わせてテオフィリンまたはアミノフィリンを使用する場合2-アゴニストの追加の気管支拡張効果は提供されませんが、副作用のリスクが高まります。 テオフィリンはβがない場合にのみ使用できます2β-アゴニスト、しかし、アミノフィリン 6 mg/kg (またはテオフィリン 5 mg/kg) の速度で、0,5 時間あたり 1,0 ~ 24 mg/kg の一定用量で XNUMX 時間静脈内投与することができます。2短時間作用型アゴニストもエピネフリンを使用できますが、使用すると重大な副作用が生じる可能性があります。 吸入粘液溶解薬、鎮静剤および抗ヒスタミン剤、硫酸マグネシウム、胸部理学療法、成人および年長の子供のための大量の水分による水分補給は、咳の増加を避けるための喘息発作の治療には推奨されません. 予防。喘息の一次予防には、喘息の前状態にある患者の治療、喘息の発症の脅威となる家族歴を持つ実質的に健康な個人の生物学的欠陥の特定、潜在的に危険なアレルゲン、刺激物、およびその他の要因の体内からの除去が含まれます。病気の発症につながる可能性のある患者の環境。 喘息前の状態の患者の治療では、感染の病巣を消毒し、アレルギー性鼻副鼻腔症を治療し、鍼灸と心理療法、運動療法、圧迫療法、スパ治療を含むさまざまな非薬物治療法を適用する必要があります。 特異的および非特異的減感作の実施が示されています。 講義番号7.呼吸器系の病気。 慢性気管支炎 慢性閉塞性気管支炎は、気管支樹のびまん性の非アレルギー性炎症性病変であり、さまざまな薬剤の気管支に対する長期の刺激作用によって引き起こされ、進行性の経過をたどり、閉塞性肺換気、粘液形成、および気管支の排出機能を特徴とします。咳、痰、息切れによって現れる木。 WHOの定義によれば、患者が3年以上連続して少なくとも2か月間、ほとんどの日に喀痰を咳をする場合、その疾患は慢性気管支炎(CB)と見なされます。 慢性気管支炎は原発性と続発性に分けられます。 原発性慢性気管支炎は、他の気管支肺プロセスや他の臓器やシステムへの損傷とは関係のない独立した疾患であり、気管支樹のびまん性病変があります。 二次性CBは、肺(結核、気管支拡張症など)と肺外(尿毒症、うっ血性心不全など)の両方の他の疾患を背景に発症します。 ほとんどの場合、それは本質的に局所的です(部分的)。 プライマリ HB を検討してください。 病因。外因性要因(タバコの煙、大気汚染、職業上の不利な条件、気候および感染性要因)と内因性要因(鼻咽頭の病理、鼻呼吸障害、繰り返される急性呼吸器疾患、急性気管支炎および上気道の局所感染)の両方CB.経路、遺伝的素因、代謝障害(肥満)の発達に役割を果たします)。 病因。外因性の影響下および気管気管支樹における内因性因子の関与により、粘膜および粘膜下層の構造的および機能的特性が変化し、粘膜の炎症が発生し、気管支の開存性および排液機能が破壊される。 粘膜および粘膜下層の構造的および機能的変化は、杯細胞、気管支腺の過形成および機能亢進、粘液および粘液の過剰分泌で発現し、粘液線毛輸送システムの破壊につながります。 分泌型 IgA-リゾチームとラクトフェリンの産生量が減少します。 粘膜の浮腫が発生し、その後、上皮の萎縮と化生が発生します。 粘膜の炎症は、感染(ウイルスおよび細菌)と組み合わされたさまざまな刺激物によって引き起こされます。 空気中に含まれる化学物質(汚染物質)は、気道に有害な影響を及ぼし、粘膜の腫れが起こり、繊毛上皮の活動の阻害が起こります。 これは、避難の違反と気管支粘膜のバリア機能の低下につながります。 カタル性内容物は、カタル性化膿性に置き換えられ、その後化膿性になります。 気管支樹の遠位部への炎症プロセスの広がりは、界面活性剤の産生を妨害し、異物粒子を貪食する肺胞マクロファージの活動を低下させます。 炎症の場合に発生する気管支痙攣が顕著である場合、気管支痙攣性(非アレルギー性)成分が発生します。 炎症の増悪中の関連する感染は、喘息(アレルギー)成分の発症に寄与し、そのようなCBを喘息前に帰することを可能にします。 閉塞性症候群は、多くの要因の組み合わせにより発症します。 1)外因性因子の刺激作用および粘膜の炎症性変化の結果としての気管支の平滑筋のけいれん; 2) 粘液の過剰分泌、そのレオロジー特性の変化、粘液線毛輸送の混乱および粘性秘密による気管支の閉塞につながる; 3) 円筒状から重層扁平上皮への上皮化生およびその過形成; 4) 界面活性剤の生産の違反; 5) 炎症性浮腫および粘膜浸潤; 6) 小気管支の崩壊および細気管支の閉塞; 7) 粘膜のアレルギー性変化。 大口径の気管支がプロセスに関与している場合(近位気管支炎)、気管支閉塞は発現しません。 しかし、中小規模の気管支が損傷した場合、気管支の開存性が著しく損なわれます。 しかし、小さな気管支 (遠位気管支炎) の孤立した病変では、咳受容体がなく、息切れが気管支炎の発症の唯一の証拠である可能性があり、大きな気管支がプロセスに関与すると咳が現れます。 粘膜の変化のさまざまな比率は、特定の臨床形態の形成を引き起こします: 1)カタル性の非閉塞性気管支炎では、粘膜の構造的および機能的特性の表面的な変化が優勢です。 2)粘液膿性(化膿性)気管支炎では、感染性炎症のプロセスが優勢です。 ただし、感染症の追加による長期のカタル性気管支炎が粘液膿性などになる可能性もあります。慢性気管支炎のすべての臨床形態の非閉塞性バリアントでは、換気障害がわずかに顕著です。 3)閉塞性障害は、最初は疾患の悪化を背景にのみ現れ、気管支の炎症性変化、高および呼吸困難、気管支痙攣(閉塞の可逆的要素)によって引き起こされますが、閉塞性症候群が成長する間、それらは絶えず持続しますゆっくり。 閉塞性慢性気管支炎では、粘膜および粘膜下層の肥厚、浮腫および過分泌が優勢であり、持続的な換気障害も特徴的です。 小気管支の閉塞が進行すると、肺気腫につながります。 その過程で、HBは特定の進化を遂げます。 肺気腫および肺硬化症の発症の結果として、肺の不均一な換気が認められ、高換気および低換気領域が形成されます。 局所的な炎症性変化と組み合わせて、これは、ガス交換障害、呼吸不全、動脈性低酸素血症、および肺高血圧症を引き起こし、その後、生命を脅かす主な状態である右心室不全を発症します。 分類。現在、一般に受け入れられている CB の分類はありません。 CB を閉塞性バリアントと非閉塞性バリアントに分類することが重要であり、それぞれのバリアントでカタル性 (粘膜)、カタル性化膿性、または化膿性炎症過程が発症する可能性があります。 分類には、出血性および線維性CBなどのまれな形態も含まれます。 気管支損傷のレベルに応じて、彼らは区別します:主な病変、大気管支(近位気管支炎)と小気管支の主な病変(遠位気管支炎)(N. R. Paleev、1985)。 臨床画像。 CB の主な症状は、咳、痰、息切れです。病気の悪化中、または肺不全やその他の合併症の発症を伴う低酸素症により、一般的な症状(発汗、衰弱、体温の上昇、疲労など)が確認されます。咳はこの病気の最も典型的な症状です。喀痰の性質と粘稠度に基づいて、病気の経過にはさまざまな変化があると推測できます。非閉塞性カタル性気管支炎では、咳に伴って少量の粘液状の水様痰が放出されます(通常は午前中、運動後、または呼吸の増加により)。病気の初期には、咳は患者を悩ませません。発作性咳嗽の出現は、気管支閉塞の発症を示します。咳は吠え声を帯び、本質的に発作性であり、気管と大きな気管支の顕著な呼気虚脱を伴います。 化膿性および粘液膿性気管支炎では、患者は痰の咳をより心配します。 病気が悪化した場合、喀痰は化膿性を獲得し、その量が増加し、時には喀痰が困難に排泄されます(悪化中の気管支閉塞のため)。 気管支炎の閉塞性変種では、咳は非生産的でハッキングであり、息切れを伴い、少量の痰を伴います。 息切れは、慢性気管支炎のすべての患者にさまざまな時期に発生します。 「長時間の咳」患者における息切れの出現は、最初はかなりの身体的運動を伴い、気管支閉塞が追加されたことを示しています。 病気が進行するにつれて、息切れがより顕著になり、一定になります。つまり、呼吸(肺)機能不全が発生します。 非閉塞性バリアントでは、CB はゆっくりと進行し、息切れは通常、病気の発症から 20 ~ 30 年後に現れます。 そのような患者は、病気の発症を治すことはほとんどありませんが、合併症の出現または頻繁な悪化を示すだけです。 風邪に対する過敏症の病歴があり、ほとんどの患者が長期喫煙を報告しています。 多くの患者では、この病気は職場での職業上の危険に関連しています。 咳の病歴を分析するときは、患者が気管支肺装置の他の病状(結核、腫瘍、気管支拡張症、じん肺、結合組織の全身性疾患など)を持っていないことを確認する必要があります。同じ症状。 気管支粘膜の軽度の脆弱性による喀血を示す病歴がある場合もあります。 再発性喀血は、出血性の気管支炎を示します。 さらに、慢性の長期気管支炎における喀血は、肺がんまたは気管支拡張症の最初の症状である可能性があります。 診断法。聴診により、呼吸困難(肺気腫の発症により呼吸が弱くなる可能性がある)と散在性の乾いた喘鳴が明らかになり、その音色は影響を受けた気管支の口径によって異なります(呼気時によく聞こえる喘鳴は、小さな気管支の損傷の特徴です) )。 聴診データの変化は、寛解期の慢性非閉塞性気管支炎では最小限であり、プロセスの悪化中に最も顕著になります(良好な咳と喀痰の生成後に消える可能性のあるさまざまな口径の湿性ラ音)。 閉塞性気管支炎が悪化すると、息切れが増し、呼吸不全の現象が増します。 化膿性の粘性の秘密は、気管支の開存性をさらに複雑にします。 気管支炎のカタル性および粘液化膿性形態の両方に加わった閉塞性成分は、悪化の期間中またはそれらの進化の過程で、気管支炎の経過を著しく悪化させます。 気管支閉塞の徴候:穏やかで特に強制的な呼吸を伴う呼気相の延長。 呼気時の喘鳴(強制呼吸と仰臥位での聴診がより良い); 閉塞性肺気腫の症状. 慢性気管支炎の進行例および合併症の追加、肺の気腫、呼吸器および心臓(右心室)の機能不全の徴候 - 代償不全の肺心臓が現れる:先端チアノーゼ、脚および足の過敏症または腫れ、爪の変化時計眼鏡の形、および手と足の終末指骨 - ドラムスティックの形、頸静脈の腫れ、右心室による上腹部の脈動、II 肋間腔の II トーンのアクセント胸骨、肝臓の拡大の左側に。 気管支喘息に似ている場合、病気の画像と喘息(アレルギー)成分の追加に影響を与えます。 実験室および機器の指標は、プロセスの段階に応じて重要度が異なります。 病気の初期または寛解期には、変化がない場合があります。 ただし、これらの指標は、炎症過程の活動を特定するために非常に重要です。 疾患の臨床形態の明確化; 合併症の特定; 同様の臨床症状を有する疾患との鑑別診断。 胸部臓器のX線検査は、慢性気管支炎のすべての患者で行われますが、原則として、単純X線写真では肺に変化はありません。 肺動脈硬化症の発症により、肺パターンのメッシュ変形がある場合があります。 プロセスの長い過程で、肺気腫の兆候が明らかになります。 肺心臓の発達に伴い、肺動脈の幹の膨らみが心臓の影の左側の輪郭に現れ、基底動脈が拡張し、続いてそれらの円錐形の狭窄と末梢血管の直径の減少が起こります。枝。 X線検査は、合併症(急性肺炎、気管支拡張症)の診断や、同様の症状を伴う疾患との鑑別診断において重要な役割を果たします。 気管支造影は、気管支拡張症の診断にのみ使用されます。 気管支鏡検査は、慢性気管支炎の診断と、同様の臨床像を示す疾患との鑑別において非常に重要です。 炎症過程の存在を確認します。 炎症の性質を明らかにします(出血性または線維性気管支炎の診断は、この研究の後にのみ行われます)。 気管気管支樹の機能障害を明らかにします(呼気虚脱 - 気管および大気管支のジスキネジーを特定することが特に重要です)。 気管支樹の有機病変の特定に役立ちます。 さらに、気管支鏡検査では、微生物学的、寄生虫学的、および細胞学的研究のために気管支または洗浄液の内容物を取得できます。 外呼吸の機能の研究は、肺換気の制限的および閉塞性障害を特定するために行われます。 スパイログラムによると、Tiffno 指数が計算されます (1 秒間の強制呼気量の比率 - FEV1 肺の肺活量 - パーセンテージとしての VC) および空気速度の指標 - PSV (肺の最大換気量の比率 - VC に対する MVL)。 閉塞性症候群の発症に伴い、外呼吸の絶対速度指標(MVLおよびFEV)が減少します1) VC の削減の程度を超えています。 ティフノ指数が低下し、呼気時の気管支抵抗が増加します。 ニューモタコメトリーによれば、呼気力に対する吸気力の優勢は、気管支閉塞の初期徴候として明らかにされる。 気管支樹のさまざまなレベルでの気管支の開存性の違反の識別は、「流量 - 体積」曲線を得ることができる特別な呼吸気流計の助けを借りて可能です。 末梢閉塞は、低容量領域での流量 - 容量曲線の大幅な減少によって特徴付けられます。 気管支抵抗と肺気量の共同評価も、閉塞のレベルを決定するのに役立ちます。 大きな気管支のレベルで閉塞した場合、肺の残存量(RLV)が増加し、総肺気量(TLC)は増加しません。 末梢閉塞では、TRLのより有意な増加とTRLの増加が観察されます。 気管支閉塞の総割合における気管支痙攣の割合を特定するために、一連の薬理学的試験の後に換気および呼吸力学が研究されています。 気管支拡張薬エアロゾルの吸入後、気道閉塞の痙性成分の存在下で換気性能が向上します。 放射性同位元素 133Xe を用いた肺動脈造影検査は、小気管支の閉塞に伴う不均一な換気を検出するために行われます。 これは、このタイプの気管支閉塞の最も初期の診断徴候です。 心電図検査は、肺高血圧症で発症している右心室と右心房の肥大を検出するために必要です。 QRS軸の右への顕著なずれ、移行ゾーンの左へのシフト(V1-V4ではR / S < 6)、S型ECGが検出されます。 VF、III、II 誘導の高く鋭い P 波。 臨床血液検査では、重度の肺不全の発症を伴う慢性低酸素症に起因する二次性赤血球増加症が明らかになります。 「急性期」指標は中程度に表現されています。ESRは正常または中程度に増加しており、白血球増加は小さく、白血球の式が左にシフトしています。 アレルギー症状の証拠として、好酸球増加症の可能性があります。 喀痰および気管支内容物の研究は、炎症の重症度を確立するのに役立ちます。 重度の炎症では、内容物は化膿性または化膿性粘液であり、多くの好中球と単一のマクロファージを含み、ジストロフィーに変化した繊毛上皮および扁平上皮の細胞はほとんど見られません。 中程度の炎症の場合、内容物は粘液膿性に近くなります。 好中球の数が減少し、マクロファージ、粘液、気管支上皮細胞の数が増加します。 軽度の炎症では、気管支の内容物は粘液であり、上皮の落屑した細胞であり、気管支が優勢です。 マクロファージと好中球はほとんどありません。 喀痰と気管支内容物の微生物学的検査は、慢性気管支炎の悪化の病因と抗菌療法の選択を特定するために重要です。 差動診断. 表10 CBの鑑別診断基準
治療。病気の増悪期と寛解期で異なる一連の対策が含まれます。慢性疾患の悪化の期間中、治療の2つの方向が区別されます:異屈性と病因性。 等方性治療は、気管支の炎症過程を排除することを目的としています。抗生物質、スルファニルアミド薬、消毒薬、フィトンチッドなどによる治療が適応となります。治療は、ペニシリンシリーズの抗生物質(ペニシリン、アンピシリン)またはセファロスポリンのグループ(セファメシン)で開始されます。 、ツェポリン)、および効果がない場合、グループの抗生物質は予備として使用されます(ゲンタマイシンなど)。 最も好ましい投与経路は気管内(エアロゾルまたは気管支鏡を通して喉頭注射器で満たす)です。 病因治療は、肺の換気を改善することを目的としています。 気管支開存性の回復; 肺高血圧症と右心室不全の制御。 気管支の炎症過程の排除に加えて、肺換気の回復は、酸素療法と運動療法によって促進されます。 慢性気管支炎の治療における主なもの - 気管支の開存性の回復 - は、それらの排水を改善し、気管支痙攣を排除することによって達成されます。 気管支の排液を改善するために、去痰薬(熱いアルカリ飲料、ハーブの煎じ薬、ムカルチンなど)、粘液溶解薬(アセチルシステイン、ブロムヘキシン、化膿性の粘性分泌物 - タンパク質分解酵素のエアロゾル - キモプシン、トリプシン)が処方されます。 治療用気管支鏡検査が使用されます。 気管支痙攣を解消するために、ユーフィリン(静脈内、坐剤、錠剤)、エフェドリン、アトロピンが使用されます。 交感神経刺激薬のエアロゾルでの単一の予約が可能です:フェノテロール、硫酸オルシプレナリン(喘息ペンタ)、および新しい国内薬「ソベントール」、抗コリン薬:アトロベント、トロベントール。 長期アミノフィリン(テオペック、テオドール、テオベロングなど)の効果的な製剤 - 2日XNUMX回。 そのような治療の効果がない場合、少量のコルチコステロイドを経口投与(10日あたり15〜50 mgのプレドニゾロン)または気管内投与(ヒドロコルチゾン懸濁液 - XNUMX mg)します。 追加の治療として、次のように任命します 1)鎮咳薬:非生産的な咳を伴う-リベキシン、ツスプレックス、ブロムヘキシン、ハッキング咳を伴う-コデイン、ジオニン、ストップツシン; 2)体の抵抗力を高める薬:ビタミンA、C、グループB、生体刺激剤。 現在、慢性気管支炎の治療では、免疫矯正薬がますます使用されています。T-アクチビンまたはチマリン(100mgを3日間皮下投与)。 内部 - カテゲン、ヌクレイン酸ナトリウムまたはペントキシル(2週間以内)、レバミゾール(デカリス)。 理学療法治療:ジアテルミー、塩化カルシウム電気泳動、胸部の石英、胸部マッサージ、呼吸法を処方します。 中等度および重度の気管支炎では、再発防止および療養所での治療とともに、多くの患者が常に補助的な薬物治療を受けることを余儀なくされています。 維持療法は、気管支の開存性を改善し、肺高血圧症を軽減し、右心室不全と戦うことを目的としています。 増悪期と同じ薬が処方されますが、コースでは少量でのみ処方されます。 予報。完全回復の予後は好ましくありません。予後が最も好ましくないのは、閉塞性 CB および遠位気管支への主な損傷を伴う CB で、急速に肺不全の発症と肺性心の形成につながります。最も良好な予後は、閉塞のない表在性 (カタル性) CB の場合です。 講義番号8.呼吸器系の病気。 肺炎 肺炎は、局所的な性質の急性の感染性および炎症性疾患であり、肺の呼吸セクションおよび間質性結合組織が病理学的プロセスに関与しています。 E. V. ゲンビツキーによる分類 (1983). 病因別: 1) バクテリア (病原体を示す); 2) ウイルス性 (病原体を示す); 3) 皮質; 4) リケッチア; 5) マイコプラズマ; 6) 真菌; 7) 混合; 8) 感染性アレルギー; 9) 原因不明。 病因別: 1)一次(独立した急性炎症プロセス); 2)二次性(肺循環の循環障害を伴う心血管系の疾患の合併症、腎臓の慢性疾患、血液系、代謝、感染症、または慢性呼吸器疾患を背景に発症する)。 臨床的および形態学的特徴: 1)実質(肺炎球菌性肺炎の場合):群生; フォーカル; 2) インタースティシャル。 ローカリゼーションと範囲別: 一方的。 二国間。 重症度別: 非常に深刻。 重い; 適度; 穏やかで流産。 下流:シャープ。 長引く(肺炎の放射線学的および臨床的消散)。 病因。ほとんどの肺炎は感染起源です。アレルギー性肺炎や物理的または化学的要因によって引き起こされる肺炎はまれです。細菌性肺炎は中年および高齢者でより頻繁に診断されます。ウイルス性肺炎 - 若者に発生。原発性細菌性肺炎の病因では、主役は肺炎球菌に属します。インフルエンザの流行中は、日和見微生物だけでなく、ウイルスと細菌の関連性(通常はブドウ球菌)の役割が増加します。 続発性肺炎では、主な病因はグラム陰性菌 (肺炎桿菌およびインフルエンザ菌) です。 誤嚥性肺炎の発生には、嫌気性感染の重要性が大きい。 病因。感染性病原体は、吸入と吸引(鼻咽頭または中咽頭から)によって、外部から気管支を通って肺の呼吸器部分に侵入します。血行性経路により、病原体は主に二次性肺炎または血栓性肺炎の発症中に肺に侵入します。肺炎の発生を伴うリンパ系感染の広がりは、胸部の傷でのみ観察されます。 肺のミクロフローラの活性化により、肺組織の炎症を発症する内因性のメカニズムもあります。 その役割は続発性肺炎で素晴らしいです。 肺炎の発症は、外部および内部環境の好ましくない要因によって促進され、その影響下で、身体の一般的な非特異的耐性の低下(食作用の抑制、溶菌素の産生など)および局所の抑制があります。防御機構(粘液線毛クリアランスの障害、肺胞マクロファージおよび好中球の食作用活性の低下など)。 肺炎の病因においても、アレルギー反応および自己アレルギー反応が非常に重要です。 抗原になる腐生植物および病原性微生物は、抗原抗体反応が起こる気道の粘膜の細胞に固定される抗体の産生に寄与し、それが組織の損傷および炎症過程の発症につながります。 微生物および肺組織の一般的な抗原決定基の存在下で、または肺組織がウイルス、微生物、毒素および毒性物質によって損傷を受け、その抗原特性の発現につながると、自己アレルギープロセスが発生します。 これらのプロセスは、病理学的変化のより長い存在と病気の長期化に寄与します。 臨床画像。主な症候群: 1)中毒(全身の脱力感、倦怠感、頭痛、筋肉痛、息切れ、動悸、蒼白、食欲不振); 2)一般的な炎症性変化の症候群(暑さ、悪寒、発熱、急性期血球数の変化:白血球処方の左へのシフトを伴う白血球増加症、ESRの増加、フィブリノーゲンレベル、α2-グロブリン、C反応性タンパク質の出現); 3)肺組織の炎症性変化の症候群(咳と痰の出現、打楽器音の短縮)、声の震えと気管支発声の増加、呼吸の頻度と性質の変化、湿ったラ音の出現、放射線学的変化; 4)他の臓器やシステムの関与の症候群。 これらの症状の重症度は、肺炎の経過の重症度を特徴づけます(表11を参照)。 表11 肺炎の症状と経過
肺炎の経過のさまざまな段階で、肺および肺外の特定の合併症の追加により、臨床像が変化する可能性があります。 肺: 膿瘍の形成; 胸膜炎(パラおよびメタニューモニック)、頻度は低い - 胸膜膿胸; 喘息成分の加入、肺水腫の形成、および急性呼吸不全の発症が可能です。 肺外合併症:感染性毒性ショック(急性血管、急性左心室および腎不全、消化管の粘膜の潰瘍および出血、播種性血管内凝固の発症を伴う; 感染性アレルギー性心筋炎; 感染性心内膜炎; 心膜炎;髄膜炎または髄膜脳炎; 腎炎; 肝炎 重度のcroupous pneumoniaでは、中毒性精神病が発症する可能性があり、融合した総肺炎 - 急性肺心臓. 肺炎患者の主な症状:咳、喀痰、胸痛、呼吸や咳による悪化、息切れ、全身の健康障害、発熱。 咳は乾性または痰を伴う場合があります(粘液、粘液膿性、化膿性粘液、血性)。 「さびた」痰は、大葉性肺炎、血まみれの特徴です-クレブシエラ(フリドランダー菌)およびウイルス性肺炎によって引き起こされる肺炎; 化膿性の血痰は、連鎖球菌由来の肺炎を示します。 マイコプラズマ肺炎では、少量の粘液性痰を伴う持続性の咳が観察され、喉の痛みも特徴です。 深呼吸と咳によって悪化する側部の痛みは、肺炎球菌性肺炎の特徴であり、胸膜が病理学的過程に関与していることも特徴です。 肺炎が肺の下部に限局し、横隔膜胸膜がその過程に関与している場合、急性腹症の写真をシミュレートして、痛みが腹腔に広がる可能性があります。 左肺の上部または下部の葦の部分がプロセスに関与している場合、痛みは心臓の領域に局在します。 患者の 25% では、特に慢性呼吸器疾患や心不全を背景に発症した肺炎の場合、息切れの訴えが主なものの XNUMX つです。 息切れの重症度は、一般的な健康の侵害と並行して増加します。 重度の中毒の症状は、コルニトーシスおよびマイコプラズマ肺炎に最も特徴的であり、ブドウ球菌、インフルエンザ、および肺炎球菌 (croupous) 肺炎でも観察されます。 患者は、悪寒や発熱による体温の上昇に悩まされることがあります。 中毒と発熱の一般的な背景に対して、局所症状が現れます。 診断法。病因診断を行うには、病気の初期段階での症状を正しく評価することが重要です。嗄れ声や話すことができないのは、パラインフルエンザウイルスによって引き起こされる肺炎の特徴です。 アデノウイルスによる肺炎では、流涙、目の痛み、嚥下時の喉の痛み、気道の他の部分を変化させずに鼻から大量の分泌物が出る。 診断にとって最も重要なのは、肺組織の炎症性変化の症候群の存在です。 この症候群は、次の症状で構成されています。 1) 胸部の患側の呼吸の遅れ; 2)多かれ少なかれ、病変の投影領域での打楽器音の短縮。 3)同じ領域での声の震えと気管支発声の増加。 4)呼吸の性質の変化(ハード、気管支、弱体化など); 5) 病的な呼吸音の出現 (湿った、有声の微細な泡立つラ音およびクレピタス)。 呼吸の性質はさまざまな方法で変化する可能性があります。 集団性肺炎の初期段階では、呼気が長くなり、呼吸が弱くなる可能性があります。 肝化期では、打楽器の鈍さの増加とともに、気管支呼吸が聞こえます。 パーカッションのくすみが減少し、肺ペストの焦点が解消されると、呼吸が困難になります。 限局性肺炎では、最も持続的な症状は、呼吸困難と湿った、細かい泡立つような鳴き声です。 しかし、中枢性肺門肺炎では、物理的データは非常に貧弱に提示され、肺炎の認識は X 線検査の後にのみ可能です。 マイコプラズマ肺炎は、物理的データの不足によって区別されます。 クレブシエラ肺炎によって引き起こされる肺炎では、非常に少数の喘鳴と組み合わされた重度の中毒が観察されます。 場合によっては、聴診中に、炎症性浸潤症候群の特徴ではない多数の低音および高音の乾いたラ音が前面に出てくることがあります。 これは、慢性気管支炎を背景に発症した肺炎で発生します。 ファイファーの棒によって引き起こされる肺炎; アレルギー成分の肺炎に加入した場合。 症状は病因診断を下すのに役立ちます: 1) 風疹のような小さな斑点のある発疹とリンパ節腫脹の組み合わせの検出は、アデノウイルス感染の特徴です。 2) リンパ節の局所肥大は、病巣周囲肺炎を示します。 3)粘膜、皮膚、爪の病変を伴う真菌性肺炎; 4) 肝腎症候群と軽度の黄疸が、皮質性肺炎とクリケッチア性肺炎に見られる。 5) 典型的なクループス肺炎の場合、患者の外観は特徴的です。病変の側面に熱っぽい赤面を伴う青白い顔、ヘルペス性発疹、呼吸時の鼻翼の腫れ。 肺炎の存在とその過程における肺組織の関与の程度を明らかにするための最も重要な方法は、胸部臓器の大型X線撮影とX線検査です。 ブドウ球菌性肺炎は、プロセスにいくつかのセグメントが関与する肺病変の明確なセグメンテーションによって区別されます。 それらの特徴的な放射線学的徴候は、疾患の発症から5〜7日目に気瘤タイプの肺に複数の空洞が形成され、その後、体液が存在する壊死性空洞が形成されることです。 真の膿瘍とは異なり、空洞の構成と数は急速に変化します。 大葉性病変は、クレブシエラによって引き起こされる大葉性肺炎または肺炎の症状です。 上葉、主に右肺が最も一般的に影響を受けます。 X線検査では、胸腔内に滲出液が見られます。 多くの場合、このような滲出液は、下葉に局在し、患者の2/3で肺の複数の葉を捕捉するファイファーの棒によって引き起こされる肺炎を伴う連鎖球菌性肺炎で発生します。 X 線検査データは、軽度の聴診上の変化を伴う肺炎 (間質性および肺門性肺炎) を検出する上で特に重要です。 場合によっては、診断を明確にするために、断層撮影法と気管支造影法が示されます。これは、複雑な経過(膿瘍、胸腔内の滲出液)を伴う浸潤性変化の後退が遅れた場合の診断を明確にするのに役立ちます。 それらは、同様の臨床的および放射線学的症状を伴う他の病理学的プロセスを除外するために使用されます。 気管支造影では、肺組織の腐敗空洞と気管支拡張症の存在が明らかになり、増悪時にその周囲に浸潤性変化(病巣周囲肺炎)が生じる可能性があります。 梗塞性肺炎の診断では、肺血流の放射性核種研究が一定の役割を果たし、その違反を明らかにしています。 抗生物質を処方する前の喀痰(または気管支洗浄液)の細菌学的検査は、病原体を検出し、抗生物質に対する感受性を判断するのに役立ちます。 常に特定されている微生物が肺炎の原因物質であるとは限りません。 より正確な病因診断は、ウイルスおよび細菌抗原による補体固定反応 (RCC) および血球凝集阻害反応 (HITA) の免疫学的研究を使用して行うことができます。 ウイルス性およびウイルス性細菌性肺炎の診断では、ウイルス学的および血清学的研究が重要です(マウスの生物学的検査、発生中のニワトリ胚でのウイルス培養法、免疫蛍光法、ウイルスに対するペア血清を使用する血清学的方法では、抗体価の 4 倍の増加のみを重視します)。 喀痰検査は、肺炎の性質を明らかにするのに役立ちます。 多数の好酸球はアレルギー過程を示し、非定型細胞の存在は癌性肺炎を示します。 結核菌は結核に見られます。 弾性繊維-肺組織の崩壊の証拠。 真菌症の肺炎では、真菌の検出とともに、真菌の老廃物の抑制効果のために化膿性細菌叢が不足しています。 グラム染色された喀痰塗抹標本の顕微鏡検査によると、患者の入院初日にすでに気管支に生息しているグラム陰性菌またはグラム陽性菌について話すことができます。 炎症過程の重症度は、急性期の血液パラメータの重症度とそのダイナミクス(白血球式の変化を伴う白血球増加、ESRの増加、α含有量の増加)によって判断されます2-グロブリン、フィブリノーゲン、SRVの出現、シアル酸のレベルの増加)。 肺炎の長期経過と合併症の発症により、体の免疫反応性が研究されます。 体液性 (IgM) および細胞性 (白血球の移動の遅延、T リンパ球系を特徴付ける検査の変化) 免疫の低下には、免疫調節療法が必要です。 治療。診断後すぐに、肺炎に対する抗屈性治療を開始する必要があります。喀痰の細菌学的検査は非常に長期間にわたって行われ、この研究に対する最新のアプローチを用いたとしても、ほとんどの患者では不確実で、時には誤った結果が得られるため、考えられる病原体に関する経験的アイデアは非常に重要です。 現時点では、ペニシリンは肺炎の治療薬としての重要性を失っています。 これは、肺炎球菌およびインフルエンザ菌に加えて、肺炎の発症に病因的に重要であるという事実によるものです - マイコプラズマ肺炎およびクラミジア肺炎は、β-ラクタム群の抗生物質の殺菌効果に耐性があります。 これらの薬に対する過敏症が患者に急速に発症するという事実を見失うことは不可能です。 以上のことから、肺炎の治療ではマクロライド系薬剤が注目されており、肺炎球菌だけでなくマイコプラズマ・ニューモニエ、クラニジア・ニューモニエにも有効であることが証明されている。 しかし、エリスロマイシンは、酸性環境での安定性が低く(したがってバイオアベイラビリティが低い)、耐性のある肺炎球菌株が広く普及しているため、このグループの薬物の標準であるという事実を見失わないことが重要です。エリスロマイシンに、その臨床的価値を失っています。 最適な薬として、アジスロマイシン、ロキシスロマイシン、ロバマイシンなどのマクロライドクラスの他の薬に置き換えられました。多くのマクロライドも経口および非経口使用に使用されています(たとえば、ロバマイシン)。 その結果、それらの使用は、肺の炎症過程の重度の過程で正当化されます(たとえば、最初にロバマイシンが2〜3日間静脈内投与され、その後、病理学的過程の積極的なダイナミクスで、患者はこの薬を中に服用する)。 テオフィリンとロバマイシンは慢性閉塞性肺疾患の患者の治療に一緒に使用されるため、これらの薬物の過剰摂取の可能性を防ぎながら、テオフィリンと相互作用しないため、ロバマイシンの利点は否定できません。 マクロライドのこのサブグループ (16 員マクロライド) は、最小限の副作用しか持たない薬であることも知られています。 65歳以上の患者では、肺炎の病因スペクトルが不均一であり、慢性閉塞性肺疾患を併発しているため、半合成ペニシリンを最初の抗生物質療法に使用できます。 3〜4日、セファロスポリンの使用が正当化されます。 I世代および一部のII世代のセファロスポリンの作用範囲はグラム陽性菌およびグラム陰性菌であり、III世代のセファロスポリンは主にグラム陰性菌に作用することを思い出してください。 I世代のセファロスポリンはセファロチン(ケフリン)、セファゾリン(ケフゾール)などに代表されます。II世代の薬にはセフロキシム(ケトセフ)、セフォキシチン(ボンセフィン)などがあります。III世代のセファロスポリン:セフォタキシム(クラフォラン)、セフォペラゾン(セフォビッド)、セフトリアキソン( longacef)。 誤嚥性肺炎は、嫌気性またはグラム陰性の微生物叢に関連しており、アミノグリコシドまたは III 世代セファロスポリンとメトロニダゾール-セミコハク酸 (500 mg を 2 日 3 ~ XNUMX 回静脈内投与) の併用を決定します。 免疫不全状態は、選択された薬剤の性質にも影響を及ぼします。この場合、病原体の性質に依存します。 このような場合、適用されるスキームはアミノグリコシドと最新のセファロスポリンで構成されます。 肺炎患者に対する有効な抗生物質療法の期間は7〜10日です。 治療を処方するときは、7〜15%の場合、この治療法による効果がない可能性があることに留意する必要があります。 これは、微生物学的研究の結果に基づいて、抗生物質を交換する必要があることを示しています。 別の選択肢は、代替薬、いわゆる第二選択抗生物質の使用です: 現代のセファロスポリン、イミペネム、モノバクタム、フルオロキノロン。 フルオロキノロン(オフロキサシン、ペフロキサシン、シプロフロキサシン)は、緑膿菌や一部のグラム陽性球菌(黄色ブドウ球菌)などのグラム陰性病原菌に対して有効ですが、嫌気性菌に曝露すると不活性になります。 フルオロキノロンは、クラミジア、レジオネラ菌、マイコプラズマ感染症におけるマクロライドの代替として正当に見なすことができます。 現代のモノバクタム抗生物質は、主にグラム陰性菌(サルモネラ、赤痢菌、プロテウス、大腸菌、クレブシエラなど)に対して活性があるアズトレオナム(アズクタム)によって表されます。 また、β-ラクタマーゼの作用下でも安定しています。 イミペネム - カルバペネム群の抗菌薬は、イミペネムの代謝を阻害するシラスタチンと組み合わせてのみ処方されます。 この薬は、多くの嫌気性菌、グラム陽性球菌、グラム陰性桿菌に対して非常に効果的です。 肺炎の治療に使用される抗生物質の投与。 1)ペニシリン:ベンジルペニシリン(500〜000時間ごとに静脈内に1〜000単位、または000時間ごとに筋肉内に6〜8単位)、アンピシリン(500〜000時間ごとに筋肉内に1〜000〜000 g、または静脈内に4時間ごとに0,5 g)、アモキシシリン(経口、筋肉内、静脈内で1,0時間ごとに2,0〜6 gまたは8〜0,5時間ごとに6〜0,5 g)、オキサシリン(経口、筋肉内、静脈内で1,0〜8時間ごとに0,5 g)。 2) セファロスポリン: I 世代 - セファロチン (ケフリン) (0,5-2,0 時間ごとに 4-6 g、筋肉内、静脈内)、セファゾリン (ケフゾール) (0,5-2,0 g、8 時間ごと、筋肉内、静脈内)、II 世代 - セフロキシム (ジナセフ) 、ケトセフ)(0,75〜1,5時間ごとに6〜8 g、筋肉内、静脈内)、III世代 - セフォタキシム(クラフォラン)(1,0〜2,0 g、最大12 g /日、12時間ごとに筋肉内、静脈内)、セフトリアキソン(ロンガセフ、ロセフィン)(筋肉内、静脈内に1,0時間ごとに2,0-4,0-24 g)。 3) アミノグリコシド: ゲネタマイシン (80 時間ごとに 12 mg、筋肉内、静脈内)、アミカシン (10-15 mg/kg、12 時間ごとに筋肉内、静脈内)、トブラマイシン (ブルラマイシン) (3-5 mg/kg、8 時間ごと、筋肉内、静脈内) . 4)マクロライド系薬:エリスロマイシン(0,5~6時間ごとに8g、経口投与または0,5~1,0時間ごとに6~8gを静脈内投与)、ロバマイシン(3,0~8時間ごとに12万IU、または1,5~3,0時間ごとに8万~12万IU)時間 IV)。 5) フルオロキノロン: ペフロキサシン (レフラシン) (400 時間ごとに経口で 12 mg、IV)、シプロフロキサシン (シプロベイ) (500 時間ごとに経口で 12 mg、または 200 時間ごとに 400-12 mg を静脈内投与)、オフロキサシン (ザノシン、タリビッド) (200 mg経口で12時間ごと)。 6)テトラサイクリン:ドキシサイクリン(ビブラマイシン)(200日目に1 mg、その後の日には100時間ごとに経口で24 mg)、ミノサイクリン(ミノシン)(200日目に1 mg、その後の日には100時間ごとに経口で12 mg)、アズトレオナム(アザクタム)(1,0〜2,0時間ごとに8〜12 g)、イミペネム/シルスタチン(チエナム)(筋肉内で500〜6時間ごとに8 mg)。 原則として、病気の長期または進行性の経過が不十分な初期抗生物質療法によるものであることも重要です。 ただし、これに加えて、肺の炎症の長期的かつ持続的な経過につながる局所的および全身的な原因がいくつかあります。これらは局所気道閉塞(癌、腺腫、粘液性閉塞など)です。 気管支拡張症(先天性、後天性); 嚢胞性線維症; 免疫系の欠陥(後天性); 再発性誤嚥(アカラシア、食道がんなど); 潜在性結核感染症の活性化; 化膿性肺炎の発症; 不十分な抗生物質療法。 講義番号9。消化管の病気。 食道の病気。 食道炎および食道の消化性潰瘍 1. 急性食道炎 急性食道炎は、食道の粘膜の炎症性病変であり、数日から2〜3か月続きます。 病因と病因。病因:感染症、怪我、火傷、中毒、アレルギー反応、栄養ミス。 感染性病原体のうち、急性食道炎の最も特徴的なものは、ジフテリア、猩紅熱、腸チフスおよびチフス、インフルエンザ、パラインフルエンザ、アデノウイルス感染症、おたふくかぜです。 物理的および化学的損傷要因は、電離放射線、化学火傷、熱い食べ物と非常に冷たい食べ物、香辛料に代表されます。 分類。単一の分類はありません。急性食道炎の実用的な分類を使用することが可能です。 形態学的に、リストされたタイプの急性食道炎は区別されます:カタル性、浮腫性、びらん性、偽膜性、出血性、剥離性、壊死性、瀉血性。 病因別:感染性、化学的、物理的、消化的。 内視鏡検査段階別:1番目-粘膜の浮腫と高血症、2番目-浮腫性粘膜のひだの上部に単一のびらんが現れる、3番目-粘膜の侵食と出血の病巣を伴う粘膜の重大な浮腫と高血症、4番目-"しだれ"-びまん性に侵食された粘膜、内視鏡のわずかな接触で出血します。 臨床画像。カタル性食道炎は、急性食道炎の最も一般的な形態です。それは栄養の誤りを背景に発生します:スパイシーな、冷たい、熱い食べ物を食べるとき、軽傷を負ったとき、アルコール火傷。 それは、胸骨の後ろの灼熱感と痛みによって臨床的に現れ、患者は数日間食物を拒否することを余儀なくされます。 内視鏡的に認められた食道炎I-II度、X線 - 食道の運動亢進。 びらん性食道炎は、感染症(フィン、チフス、敗血症、真菌プロセス)およびアレルギーで発生します。 また、化学火傷や食道の損傷でも現れます。 実際、この形態の食道炎は、カタル性食道炎の進化の段階です。 主な臨床像は、基礎疾患の症状で構成されています。 臨床症状はカタル性食道炎の症状に類似しています。 胸やけ、げっぷ、唾液過多、口からの腐敗臭(カコスミア)。 内視鏡的にII~III度の食道炎の徴候を確認します。 組織学的検査により、充血、粘膜浮腫、出血、びらんが明らかになった。 X線検査では、食道に豊富な粘液、長さ1cmまでの縦型の平らなバリウムデポの形成を伴うレリーフの再構築、および食道壁の運動亢進が示されます。 出血性食道炎は、びらん性食道炎のまれな臨床形態です。 病因はびらん性食道炎と同じです。 激しい痛みの症候群と吐血は臨床的に典型的です。 内視鏡検査では、出血性成分が優勢なグレード III ~ IV の炎症が明らかになります。 出血している粘膜が細く細い帯状に剥がれています。 線維性(偽膜性)食道炎。 その病因は、猩紅熱、ジフテリア、血液疾患、真菌性疾患、放射線療法の影響です。 クリニックは嚥下障害と激しい痛みが支配的であり、食事、吐き気、嘔吐の後に悪化します。 嘔吐すると、フィブリンフィルムが放出され、喀血が起こる可能性があります。 内視鏡検査では、粘膜の患部に、粘膜の表面を覆うフィブリンとデトリタスの層によって形成された、灰色および黄灰色の線維性プラークが見られます。 偽膜の拒絶により、平らでゆっくりと治癒する侵食が形成され、時には潰瘍が出血します。 重度の感染過程の後、膜性狭窄が食道に残り、ブジーナージュを繰り返すと消失します。 病因による膜性(剥離性)食道炎は、化学的(食道の熱傷)、感染性(原因は敗血症、帯状疱疹、天然痘、全身性ヘルペス感染)です。 病気の診療所はさまざまです-内視鏡で診断された軽度の形態から重度の形態まで。 重度の膜性食道炎の診療所では、中毒、嚥下障害、および疼痛症候群が蔓延している。 出血の可能性、食道の穿孔、縦隔炎、これは原則として死に至ります。 内視鏡検査では、食道のすべての層への損傷が観察され、その上皮は層によって拒絶されます。 基礎疾患が治まると、対称性および非対称性の膜性または粗い瘢痕性狭窄が食道に残ることがあります。 壊死性食道炎は、食道の急性炎症のまれな形態です。 その発達は、敗血症、腸チフス、カンジダ症、末期腎不全などの重篤な疾患における免疫力の低下によって促進されます。 クリニックは、痛みを伴う嚥下障害、嘔吐、全身の衰弱、出血、縦隔炎の頻繁な発症、胸膜炎、肺炎を特徴としています。 基礎疾患の治療後、狭窄は食道に残り、通性前癌性変化と診断されます。 敗血症性食道炎は、連鎖球菌性病因の食道壁のまれな局所またはびまん性炎症であるか、または粘膜が火傷、潰瘍を伴う異物によって損傷を受け、隣接する臓器から通過する可能性がある場合に発生します。 急性食道炎は、あらゆる形態の急性食道炎の合併症として発生することがあり、食道壁の化膿性癒合を引き起こします。 壁の崩壊は、縦隔の組織への膿の突破、縦隔炎、胸膜炎、化膿性気管支炎、肺炎、脊椎炎、大動脈または他の大血管の破裂を伴う。 嫌気性菌感染症への加入は、縦隔肺気腫または自然気胸につながる可能性があります。 臨床像は、重度の中毒、高熱、胸骨の後ろと首の痛み、嘔吐が特徴です。 検査では、首に腫れがあり、脊椎のこの部分の可動性が制限されています。 頭の位置は強制され、片側に傾いています。 この疾患はしばしば化膿性縦隔炎に変化します。 血液検査では、白血球増加症、ESRの加速。 急性期の器械検査(X線、内視鏡)は適応外。 瘢痕化の期間中は、肉眼的奇形および食道の瘢痕性狭窄を発症するリスクがあるため、X線検査が必須です。 治療。急性食道炎の治療原則:不屈性、病因性、症候性。 エチオトロピック治療 - 基礎疾患の治療。 急性食道炎を合併した感染症では、抗生物質が(非経口的に)使用されます。 食道に顕著な壊死性および出血性の変化があるため、2〜3週間は食事を控えることをお勧めします。 この期間中、非経口栄養、タンパク質加水分解物の静脈内投与、アミノ酸の混合物、イントラリピッド、ビタミン、解毒療法が必要です。 炎症を軽減した後、熱的および化学的に控えめな食品が処方されます:温かい牛乳、クリーム、野菜スープ、液体シリアル。 炎症の局所症状を軽減するために - タンニン1%、カラーゴール - 2%、ノボカイン - 食事前に1-2%の内部溶液。 収れん剤は、ベッドの頭を低く下げた水平位置で採取されます。 収斂剤の局所投与の効果がない場合、非麻薬性鎮痛薬は非経口的に処方されます。 食道ジスキネジアの影響を軽減するために、運動促進薬(セルカル、ラグラン、シサプリド)が食事の前に経口で使用されます。 複数の侵食、ビスマス製剤(デノール、ビカイア)、ソルコセリルの注射が必要です。 出血を伴う出血性食道炎では、アミノカプロン酸製剤、ビカソール、ジシノンが使用されます。 大量出血では、血液または血漿の輸血が処方されます。 化膿性壊死性食道炎では、患者は長期間非経口栄養を摂取する必要があり、いくつかの抗生物質による大規模な治療が使用され、膿瘍が排出されます。 食道狭窄はブギエナゲによって矯正されます。 まれに、胃瘻造設術が行われます。 予報。カタル性食道炎およびびらん性食道炎の予後は良好です。基礎疾患が適切に矯正されれば、食道炎の症状が自然に消えることは可能です。偽膜性食道炎、落葉性食道炎、および痰性食道炎の予後は重篤です。すべての場合において、基礎疾患からの回復を条件として、食道炎は瘢痕狭窄の形成で終わり、その後矯正が必要になります。食道狭窄を合併した重度の食道炎の患者は働くことができません。 急性食道炎の予防は、基礎疾患の適切かつタイムリーな診断と治療にあります。 2.慢性食道炎 慢性食道炎は、食道の粘膜の慢性炎症で、最長6か月続きます。 最も一般的な変種は消化性食道炎(逆流性食道炎)であり、食道の消化性潰瘍を合併する可能性があります。 病因と病因。この病気の主な原因は、胃内容物の食道への絶え間ない逆流であり、場合によっては胆汁や腸内容物も逆流します。つまり、消化性食道炎は胃酸による食道の無菌性火傷です。 逆流性食道炎の病因では、酸性内容物の逆流と、食道の浄化と排出の違反が重要です。 化学的刺激による食道のクリアランス速度は、食道クリアランスと呼ばれます。 通常のクリアランスでは、攻撃的な分泌物の単一の逆流は逆流性食道炎を引き起こしません。 温かい食べ物、アルコール、喫煙、その他の外因性の要因により、食道のクリアランスが減少します。 これらの要因には、かなりの量の空気が食物と一緒に飲み込まれるファーストフードが含まれます。 食品の品質も重要です。脂肪の多い肉、ラード、パスタ、スパイシーな調味料は、胃からの食品の排出を遅らせ、その後、内容物が食道に逆流するのを助けます。 薬物は、下部食道括約筋の緊張を大幅に低下させ、逆流を促進します:カルシウム拮抗薬、硝酸塩、麻薬性鎮痛薬、抗コリン作動薬、テオフィリンとその類似体、プロスタグランジングループの薬。 消化性食道炎の発生における逆流の病原性には、頻度、量、逆流、化学組成、食道粘膜の状態、化学因子に対する感受性(壁の炎症が感受性を低下させる)、排出率(クリアランス)のXNUMXつの基準があります。 、これは主に活動性の蠕動、アルカリ化作用の唾液および粘液に依存します。 逆流性食道炎の発生は、横隔膜の食道開口部のヘルニア、十二指腸潰瘍、胃切除後の障害、およびアレルギーによって促進されます。 アレルギーの素因も重要です。 消化性食道炎患者の形態学的検査により、浮腫、粘膜の充血、食道の横隔膜上セグメントの粘膜下組織の浸潤が明らかになる。 慢性炎症の広がりには、完全逆流性食道炎と局所逆流性食道炎の 2 つの選択肢があります。 食道粘膜の3/XNUMX以上のプロセスに関与すると、逆流性気管炎、逆流性気管支炎が発生する可能性があります。 食道のひだの上部に、びらん、小さな潰瘍が発生します(胃内容物による最大の灌漑の場所)。 食道の慢性炎症は、痙性拘縮および臓器の短縮につながります。 臨床画像。逆流性食道炎の典型的な兆候には、胸骨の後ろの灼熱感、胸やけ、横になると悪化する逆流、嚥下障害、制酸薬の服用によるプラスの効果などがあります。狭心症を思わせる胸の痛みが食後に起こることがあります。 逆流性食道炎における痛みの発生は、酸性胃内容物の逆流中の食道壁およびそのけいれんの消化性刺激、ならびに脱出した粘膜の侵害に関連している。 この痛みの特徴:長く燃える特徴、剣状突起の局在、食道に沿った照射、胸部の左半分への照射は少ない、制酸剤、鎮痙薬の服用による顕著な効果はなく、特に後、水平位置で増加した食べる。 臨床診断では、胸骨の後ろのしこりの感覚、食道を通過する温かい食べ物の感覚など、嚥下障害の軽微な症状に特に注意を払う必要があります。 徐々に食道炎が始まる兆候は、唾液分泌と水と一緒に食べ物を飲む習慣である可能性があります。 逆流性食道炎の患者の身体検査は、診断的に重要な情報を提供しません。 逆流性食道炎の合併症には、出血、潰瘍、狭窄、食道の短縮、および悪性腫瘍が含まれます。 慢性逆流性食道炎は、軸性裂孔ヘルニアの発症につながる可能性があります。 診断と鑑別診断。この病理に対する最も価値のある研究方法は内視鏡検査であり、その際、充血、浮腫、粘膜のひだの肥厚が観察されます。粘膜を覆う白っぽいコーティングは信頼できますが、病気の初期段階では薄く、ほとんど目立たない可能性がありますが、長いプロセスが必要です-巨大な白または汚れた灰色。一部の領域では、白いプラークを背景に、食道の真っ赤な粘膜がよく見えます。場合によっては、縞模様のびらん性および潰瘍性欠陥が検出されることもあります。粘膜の変化は、充血から「泣き叫ぶ」粘膜までの食道炎の 4 つの段階のいずれかに対応します。重度の食道炎では、内腔に大量の唾液と粘液が蓄積します。内視鏡検査とは異なり、pH 測定を使用すると、食道クリアランスをより客観的に評価できます。 X線検査で胃食道逆流症が明らかになります。 胃と十二指腸の消化性潰瘍、冠状動脈性心臓病、慢性胆嚢炎、膵炎を伴う逆流性食道炎を区別する必要があります。 鑑別診断の主な症状は痛みです。 消化性潰瘍との鑑別は、食道炎の晩期および「空腹」の痛みがないこと、および食道と胃の内視鏡検査から得られたデータによって助けられます。 冠動脈痛は、食道炎とは対照的に、身体的および感情的ストレス、硝酸塩の影響、自転車エルゴメトリーによるものを含む心電図上の虚血の兆候との関連を特徴としています。 腹部臓器の超音波データは、疼痛症候群の原因として胆嚢と膵臓の病理を除外するのに役立ちます。 治療。逆流性食道炎の治療には、その原因となった病気の治療と逆流防止療法の処方が含まれます。 患者は、ウェイトを持ち上げたり、かがんだりしないようにアドバイスされています。 安静時と睡眠時に正しい位置をとる必要があります(ヘッドボードは15〜20°の角度で30〜50cm上昇します)。 体重を正常化し、少しずつ食べることをお勧めします(最後の食事-就寝の3時間前)。 アルコールや辛い食べ物は食事から除外されます。 粘膜を保護する吸着剤とアルカリ化剤を割り当てます。 これらの物質には、食事の1〜30分前に40日3回、4回目は就寝時の空腹時に8 g(できれば懸濁液の形で)経口投与されるVenterが含まれます。 治療の経過は10〜1週間です。 Almagel、phosphalugel、maalox、gastal も同様の効果があります。 これらの薬は、完全な寛解が起こるまで、消化期間(食事の2/2〜1時間後および夜間)に使用されます. Phosphalugel と Maalox は、2 日 2 ~ 3 回、2 ~ 3 パケット、1 日 3 ~ 4 錠処方されます。 ブルジェと白土の混合物であるティーソーダは、効率が悪いため使用しないことをお勧めします。 包み込む作用と収れん作用のある硝酸ビスマス4gをXNUMX日XNUMX~XNUMX回。 新しい制酸剤であるトパルカンの高い抗逆流活性が注目されました。 ミネラルウォーター - 「Borjomi」、「Essentuki No. XNUMX」、「Jermuk」、「Smirnovskaya」にはアルカリ化効果があります。 酸性の胃液分泌を減らすために、H ブロッカーが処方されます。2ヒスタミン受容体 (シメチジン、ラニチジン、ファモチジン)、Ka-K-ATPase 阻害剤 (オメプラゾール)、壁細胞の M-コリン作動性受容体の選択的遮断薬、その類似体であるブスコパン。 シメチジンは400mgを2日300回、ラニチジンは40mg、ファモチジンは30mgを夕食後の夕方に40回処方されています。 オメプラゾールは、びらん性および潰瘍性逆流性食道炎の耐性型に推奨されます。 3〜4週間、2日1〜3mgで処方されます。 逆流性疾患における運動排泄障害を正常化するために、メトクロプラミド(セルカル、ラグラン、ペリノム、バイオムラル)、プレパルシド(サイズプライド、モチリウム、ドンペリドン、コーディナックス)が処方されます。 メトクロプラミドとその第 4 世代類似体は、下部食道括約筋の緊張を高め、胃内圧を低下させ、胃からの排出を促進します。 食事の前にメトクロプラミド2錠を2日XNUMX〜XNUMX回、またはXNUMX日XNUMX回筋肉内にXNUMXmlを割り当てます。 この薬は通常、忍容性が良好です。 それを使用すると、口渇、眠気、耳鳴りが発生する可能性があり、これらは食後に減少します。 Sizepride は、新規の胃腸運動促進薬です。 下部食道括約筋の緊張を高め、食道クリアランスを改善し、消化管の運動排泄機能を高め、病理学的逆流(胃食道および十二指腸胃)を抑制します。 この薬は、メトクロプラミドとは異なり、ドナミン受容体をブロックせず、抗コリン受容体を直接刺激するものではなく、セルカルおよびその類似体に固有の副作用がありません。 5日10~2回、3mgまたは2mgを経口で処方されます。 治療の経過は3〜2週間から3〜XNUMXヶ月続きます。 逆流性食道炎のセサプリドは単剤療法として使用できます。 予後と予防。人生と仕事の予後は良好です。複雑な症例の場合、予後は医療の適時性と質によって決まります。重度の疾患を持つ患者は障害グループに割り当てられます。慢性逆流性食道炎の患者は、消化器科医の監督下にある必要があります。悪性腫瘍の可能性があるため、内視鏡検査および形態学的検査は年に少なくとも2回必要です。 3.食道の消化性潰瘍 食道の消化性潰瘍は、活動的な胃液の影響下での食道遠位部の粘膜の潰瘍形成を特徴とする急性または慢性疾患です。 病因と病因。食道の慢性消化性潰瘍は、逆流性食道炎と食道裂孔ヘルニアの合併症です。それらの発生は、内部の短い食道、粘膜の限局性化生、食道への胃粘膜の異所性、噴門機能不全を伴う逆流疾患、頻繁な嘔吐を伴う疾患(迷走神経後症候群、求心性ループ症候群、慢性アルコール依存症)によって促進されます。 食道の急性潰瘍は、食道粘膜の病的乾燥(乾皮症)、薬物アレルギー、NSAIDの使用、真菌感染症、ウイルス感染症、皮膚熱傷、および中枢神経系の疾患で起こり得る。 これらの潰瘍は症候性と見なされます。 臨床画像。一部の患者は、食道および胃十二指腸領域の粘膜に潰瘍性病変を合併しています。食道の消化性潰瘍の症状は、消化性食道炎の臨床像に似ています。持続する胸やけ、食後、前かがみになったとき、横になったときに悪化する、逆流、飲み込むときの痛み、固形食品の通過障害などです。食道潰瘍に典型的な合併症:穿孔、出血、貫通、狭窄。出血は、吐血、下血、低色素性貧血、心臓活動の低下によって現れます。食道穿孔が診断されることは非常にまれです。 穿孔の臨床症状は、異物による急性の貫通性および非貫通性の機械的損傷の症状と区別がつきません。 食道潰瘍の約 14% が周囲の組織に浸透しています。 診断と鑑別診断。臨床症状に基づいて消化性潰瘍を疑うことは非常に困難です。診断は、機器および実験室での研究中に検証されます。最も有益なのはレントゲン検査と内視鏡検査です。放射線学的には、潰瘍は、粘膜のわずかな周囲浮腫を伴う心臓上食道のニッチとして現れます。潰瘍の領域の食道はけいれん的に収縮し、その上にわずかな狭窄上の拡張が検出されます。潰瘍には運動亢進や逆流性食道炎の兆候が伴い、食道裂孔ヘルニアの症状も非常によく見られます。場合によっては、潰瘍が小さな上横隔憩室に似ていることがありますが、後者は典型的な臨床経過をたどらず、心不全、ヘルニア、または食道炎を合併することはありません。 食道の消化性潰瘍を、壁の硬直と粘膜の緩和、および非対称シャフトを伴う潰瘍性内因性癌と、放射線学的徴候によって区別することはより困難です。 食道の消化性潰瘍の検証における最も信頼できる情報は、内視鏡検査および潰瘍の端からの複数の生検によって提供されます。 内視鏡を消化性潰瘍に進めると、ステージI〜IVの食道炎、食道の運動機能障害、病巣周囲の浮腫および粘膜の充血の徴候が明らかになります。 急性潰瘍は、通常、白っぽいまたは緑色のコーティングで覆われた急峻なエッジを備えた円形または楕円形です。 慢性潰瘍は、壁が密ででこぼこの平らな底、緩やかな縁、化膿性線維性沈着物、肉芽の病巣、および瘢痕性オーバーレイを持っています。 悪性腫瘍を除外するために、潰瘍の端から 4 ~ 6 個の生検が行われます。 内視鏡検査では、食道の軸に沿って伸びる単一の消化不良が明らかになります。 それらの長さは1〜10cm以内で変化しますが、多くの場合1cmを超えません潰瘍はしばしば浅く、その底は白っぽいコーティングで覆われています。 充血、粘膜浮腫、および単一びらんは、中等度の病巣周囲の炎症反応を反映していることがよくあります。 消化性潰瘍の治癒後、食道には、粗い線状または星状の瘢痕、または粗い憩室のような壁の変形と内腔の狭窄が残ります。 食道の消化性潰瘍と特定の性質の潰瘍(結核、梅毒を伴う)を区別する必要があります。 このような状況では、特定の血清学的検査、組織学的および細菌学的研究の結果が非常に役立ちます。 食道の病状と肺や他の臓器の損傷との組み合わせにより、特定のプロセスに関連して患者を意図的に検査する必要があります。 治療。治療には食事療法が含まれます。機械的および化学的に穏やかな食品が推奨され、5 日 6 ~ 1,5 回少量ずつ摂取されます。胃から食道への内容物の逆流を防ぐために、ベッド上での患者の位置はベッドの頭が高くなければなりません。薬は寝たまま服用します。単独療法では、次の薬理学的グループのいずれかの薬物が処方されます:制酸薬や吸着剤を含む抗分泌薬、胃の運動排出機能の刺激薬(運動促進薬)、薬物 - 粘液シミュレーター。治療は3〜XNUMXヶ月という長期間行われます。 外科的治療の適応症 - 6〜9か月以内の治癒の欠如、複雑な経過(穿孔、貫通、狭窄、出血)。 予後と予防。病気の経過は再発しています。人生と仕事の予後は良好です。外来で消化器科医による内視鏡検査や生検による定期的(年に1~2回)の検査を受けることをお勧めします。 季節性(春~秋)の逆流性食道炎予防を行っています。 レクチャーNo.10。消化管の病気。 胃の病気。 慢性胃炎 慢性胃炎は、臨床的には胃の消化不良によって特徴付けられる疾患であり、形態学的には、胃粘膜の炎症性および変性変化、細胞再生プロセスの障害、および粘膜自身の膜内の形質細胞およびリンパ球の数の増加によって特徴付けられます。 病因と病因。消化器病学の発展の現段階では、慢性胃炎の発症はヘリコバクター・ピロリ(HP)の微生物の増殖によって促進され、95%の症例で前庭部胃炎、56%の症例で汎胃炎を引き起こすことが確立されています。 次に、慢性胃炎の発生のいわゆる病因は、危険因子(不規則な偏った食事、喫煙、アルコール摂取、塩酸とペプシンの過剰分泌)に高い確率で起因する可能性があります。 病気の発症における主な役割は、胃粘膜の壁細胞への抗体の蓄積、悪化した遺伝、および胃粘膜に損傷を与える薬物の使用を伴う自己免疫メカニズムにも属します。 分類。 1990年、オーストラリアで開催された第IX回国際消化器病学会では、シドニーシステムと呼ばれる慢性胃炎の新しい体系化が採用されました。 分類の組織学的基盤。 1)病因:HPに関連する慢性胃炎、自己免疫性、特発性、急性薬剤性胃炎。 2) 地形: 洞、胃底、汎胃炎。 3) 形態: 急性、慢性、特殊な形態。 分類の内視鏡的根拠: 1)胃の前庭部の胃炎; 2)胃体の胃炎; 3) 汎胃炎; 4) 胃粘膜の変化: 浮腫、紅斑、粘膜脆弱性、滲出液、扁平びらん、びらんの隆起、襞過形成、襞萎縮、血管パターンの視認性、粘膜上出血。 臨床画像。慢性胃炎は内科クリニックで最も一般的な病気の28つです。世界の住民におけるその頻度は 75 ~ XNUMX% です。 慢性胃炎は、胃の消化不良の症状および上腹部の痛みによって現れることが多い。 まれに、無症候性です。 痛みは通常、心窩部領域に局在しています。 食物摂取によるその発生と胃の炎症過程の局在化との間には明確な関係があります. 胃の心臓下および心臓部の胃炎の患者では、食後10〜15分で心窩部の痛みが発生し、食後40〜50分で胃体の病理が発生します。 「遅い」、「空腹」の痛みは、胃の出口部分の胃炎、または十二指腸炎に典型的です。 「二波」の痛み - 食事後および空腹時 - は、心臓下および洞の胃炎で観察されます。 びまん性のプロセスでは、痛みは上腹部に局在し、食事後に発生し、差し迫った性質のものです。 彼らは、上腹部の痛みと、それが内因性である場合に発生する病変との関係を確立できない場合の胃炎の無症候性経過について述べています(胃炎は他の臓器やシステムの病理に続発します)。 慢性胃炎の臨床像において同様に重要な場所は、吐き気、げっぷ(酸っぱい、苦い、腐った)、胸焼け、便秘または下痢、不安定な便などの消化不良症候群です。 孤立性幽門洞胃炎では、塩酸とペプシンの分泌過多から生じる胸焼けと便秘の訴えが最も重要になります。 重度の萎縮の兆候を伴う胃炎では、吐き気、げっぷ「腐った」、不安定な便または下痢が優勢であり、これは塩酸およびペプシンの分泌低下に典型的である。 持続性の悪心は、胆嚢の運動低下性ジスキネジアで発生する慢性膵炎、慢性胆嚢炎の続発性胃炎の特徴です。 診断法。慢性胃炎は長期間続き、時間の経過とともに症状が増加します。増悪は栄養障害によって引き起こされます。 慢性胃炎の身体像はかなり貧弱です。 病気の悪化中の患者の80〜90%では、客観的な研究により、上腹部の局所的な痛みのみが特定されます。 慢性胃炎が十二指腸炎、胆嚢炎または膵炎と組み合わされると、胃炎には典型的ではないが、別の臓器の病理に特徴的な痛みの局在を判断できます。 一般的な血液および尿検査、慢性胃炎患者の血液の生化学的パラメーターは、健康な個人の対応するパラメーターと変わりません。 生化学的研究では、分析に変化がないか、消化器疾患の兆候がある可能性があります. pH メトリによる酸分泌の胃内容物を調べると、酸分泌過多の徴候と酸産生の減少の両方が認められます。 慢性胃炎におけるペプシン形成の指標はより持続的であり、びまん性臓器損傷における持続的な無酸性の背景に対して減少します。 X線検査は、慢性胃炎の診断を確認するよりも、胃の他の病気(潰瘍、癌)を除外する可能性が高く、メネトリエ病の診断に役立ちます。 病気の臨床症状の不足、および臨床検査の非特異性のために、慢性胃炎の診断は内視鏡的および形態学的研究の結果に基づいています。 内視鏡検査は、浮腫、紅斑、粘膜の脆弱性、滲出液、平坦なびらん、隆起したびらん、ひだの過形成または萎縮、血管パターンの可視性、粘膜下出血など、さまざまな重症度の胃粘膜の変化を明らかにします。 彼らは、粘膜の自身の膜における形質細胞とリンパ球の数の増加を伴う慢性胃炎について話します(多形核白血球が現れる急性胃炎とは対照的です)。 上記に関連して、胃炎における炎症の形態学的同定は、臨床医のデータの解釈と一致しない場合があります。 胃粘膜の炎症性変化の活動は、固有層または上皮の白血球浸潤の程度に従って形態学的および形態計測的に評価されます。 自己免疫性胃炎が活動していないという事実を見失わないでください。 形態学的変化(弱い、中程度、重度)-炎症、活動、萎縮、化生-およびHP汚染の程度が定量化されます。 胃炎に特徴的な臨床症状は、消化器系の他の疾患でも観察されるため、診断の過程で、腹腔の超音波検査、消化器の徹底的な内視鏡検査および形態学的検査が必要です。 差動診断。最も困難なのは、胃の機能性疾患を伴う胃炎、胃と十二指腸の消化性潰瘍、慢性胆嚢炎と膵炎、胃がんの鑑別診断です。 慢性胃炎に似た胃の機能性疾患は、潜在的に発生するか、痛みや消化不良の症状を伴うことがあります。 それらは、短期間、疾患の臨床像に蔓延する一般的な神経症状(衰弱、疲労、過敏症、頭痛、不安定な気分、発汗など)の存在によって特徴付けられます。 胃の機能障害では、痛みは食品の品質に依存しないか、厳密に定義された製品の使用後に発生します。 多くの場合、酸性症の症候群(胸やけ、酸っぱいおくび、口の中の酸味)があり、分泌機能が亢進している胃炎とは異なり、食後には増加しませんが、興奮して長時間の食事休憩があります。 胃の機能的病状における嘔吐は、条件反射のメカニズムに従って発症し、患者に安心をもたらし、全身状態の重大な悪化にはつながりません。 慢性胃炎では、通常増悪中に発生し、患者に安心をもたらしません。 胃の機能不全の頻繁な症状は、空気の大きなげっぷです。 慢性胃炎では、食物の消化不良や胃の運動性に関連しており、分泌が維持されている場合は酸性、減少している場合は腐った卵の臭いがあります。 胃炎における胃分泌の研究では、正常な分泌値が病気の初期に検出され、将来的には胃液の分泌が減少する傾向があります。 胃の機能性疾患では、ヘテロキリアがしばしば観察されます。 胃のX線検査は、硬直性、血管炎、巨大な鋸歯状ポリポーシスなどの胃炎の形態を確認することを可能にし、胃の運動排泄機能の違反(胃下垂、低血圧)の場合、の機能的性質を示します病気。 慢性胃炎と胃の機能性疾患の鑑別診断のための最も価値のある研究方法は胃内視鏡検査であり、物議を醸す場合には、胃炎または胃の機能性疾患に特徴的な胃粘膜の変化を確認することができます。 消化性潰瘍を伴う慢性胃炎の鑑別診断については、次の講義で説明します。 胃がんは、分泌機能が低下した胃炎と非常によく似ています。 臨床徴候に基づく胃癌の早期診断は、特に長期間胃炎に苦しんでいる患者では困難です。 がんの診断にとって非常に重要なのは、食物摂取にほとんど依存しない持続的な持続的な痛みの出現、やる気のない一般的な衰弱と疲労、食欲の倒錯、および患者の体重の漸進的な減少です。 触診による腫瘍の検出は、癌プロセスの後期段階を指します。 患者の健康状態の変化、胃液の酸性度の急速な低下、塩酸の「欠乏」、胃液中の異型細胞の出現、便中の潜血に対する陽性反応などの症状は、医師に胃がんを疑わせる。 鑑別診断において決定的に重要なのは、胃粘膜の標的生検によるX線および胃内視鏡検査です。 分泌機能が低下した慢性胃炎の患者では、X線検査で粘膜の萎縮が明らかになります。これは胃内視鏡検査でも確認されます。 このような場合の標的生検では、粘膜の構造変化と萎縮が明らかになります。 胃がんの場合、X線検査は、充填欠陥の存在、粘膜のひだまたはその性質の変化の欠如、および特定の領域での蠕動の欠如によって特徴付けられます。 胃の内視鏡検査は、腫瘍がまだ胃粘膜内にあるときに、腫瘍の発生の初期段階で腫瘍を検出することを可能にし、外科的治療は症例の90%以上で回復につながります。 慢性胆嚢炎。慢性胆嚢炎では、痛みは右心季肋部に局在しており、本質的に鈍いです。結石性胆嚢炎の場合、痛みは急性の疝痛のようなもので、右肩甲下領域に広がります。痛みの発症は、脂肪分の多い食べ物を食べたり、あおり運転をしたりすることで起こります。 慢性胃炎では、上腹部の痛みはびまん性で鈍く、照射がなく、乾物を食べた直後または食事に違反して発生します。 胃炎や胆嚢炎では、痛みには消化不良の症状が伴いますが、みぞおちの重さ、満腹感、食べ物や空気のげっぷ、口の中の金属味が胃炎の特徴です。 慢性胃炎での嘔吐はまれです。 客観的に、特に結石性の慢性胆嚢炎では、前腹壁の緊張、右季肋部の皮膚知覚過敏を検出しますが、これは慢性胃炎では一般的ではありません。 慢性胆嚢炎の場合の腹部の触診では、胆嚢の局在に痛みが見られます。 慢性胃炎は、びまん性の痛みが特徴です。 慢性胆嚢炎の患者では、胆汁検査で粘液と白血球の量の増加が明らかになります。 慢性胃炎は、胃液の分泌と酸性度の変化、および胃の他の機能(吸収、運動)の背景に対する胆汁の正常な画像によって特徴付けられます。 慢性胆嚢炎患者の胆嚢のX線検査では、結石だけでなく、胆嚢の排出機能の変化が明らかになります。 慢性膵炎。慢性膵炎では、痛みは腹部の左半分に局在し、左肩甲下領域、腰部、および周囲領域に広がります。痛みの発生は、脂肪の多い食べ物やアルコールを大量に摂取することに関連しています。 慢性胃炎が病気の長く単調な経過を特徴とする場合、慢性膵炎では段階的です。 慢性膵炎の場合の客観的検査では、左季肋部の皮膚の知覚過敏が明らかになり、痛みは局所的に膵臓の位置に対応します。 慢性膵炎における膵液の実験室での研究では、アルカリ度と酵素の持続的な変化が見られます.血液と尿中のジアスターゼのレベルが変化する可能性がありますが、慢性胃炎には当てはまりません. 放射線学的には、慢性膵炎は、十二指腸輪の逆転の増加、主要な乳頭の急激な増加 (フロストバーグ症状)、および時には膵臓の石灰化領域の存在によって特徴付けられます。 さまざまな形態の慢性胃炎の鼻腔内診断も実施する必要があります。 したがって、HPに関連する疾患は、臨床的に十二指腸潰瘍の症状を伴って進行し、場合によっては潜在的に進行する可能性があります。 内視鏡的および形態学的検査は、antropylorhoduodenitisを明らかにします。 ヘリコバクターピロリ胃炎のびらんは通常、重度の炎症の領域(胃の人為的幽門帯)に局在します。 自己免疫性慢性胃炎は、上腹部の重苦しさ、口の中の不快な後味、腐ったげっぷ、吐き気によって臨床的に特徴付けられます。 塩酸の産生が不十分なため、下痢が現れます。 症例の10%で、自己免疫性胃炎を背景に、症状が見られますB12- 欠乏性貧血:脱力感、皮膚および粘膜の蒼白、脆い爪、血液検査 - 濃色性巨赤芽球性貧血。 病気の特殊な形態には、肉芽腫性、好酸球性、肥大性(メネトリエ病)、リンパ球性胃炎が含まれます。 肉芽腫性胃炎は、病気の独立した形態として、またはより深刻な病状(クローン病、結核、サルコイドーシス)の構成要素のXNUMXつとして機能することがよくあります。 診断は常に胃粘膜の生検の組織学的検査の結果によって確認されます。 好酸球性胃炎は非常にまれで、全身性血管炎によって引き起こされます。 アレルギー反応の履歴は必須です。 組織学的検査は、胃粘膜の好酸球浸潤を明らかにする。 肥大型胃炎(メネトリエ病)は、上腹部の痛みと吐き気によって臨床的に現れます。 一部の患者は、下痢のために体重が減少することがあります。 内視鏡的、放射線学的および形態学的研究では、巨大な肥大した粘膜ひだが発見され、脳の畳み込みに似ています。 リンパ性胃炎は臨床的に無症候性です。 形態学的には、この形態は、リンパ球による胃粘膜への顕著な浸潤を特徴としています。 治療。胃炎患者には、定期的なバランスの取れた栄養補給、仕事と休息のスケジュールの正常化、日常生活や仕事におけるストレスの多い状況の平準化など、一般的な医学的対策が必要です。 薬物療法は、慢性胃炎の臨床症状がある場合にのみ適応されます。 HPに関連する胃炎の患者は消化性潰瘍プログラムで治療されます(次の講義を参照)。 自己免疫性胃炎のある人はビタミンBの補給が必要です12 (500日1回30 mcgを5日間皮下投与し、その後一連の治療を繰り返す)、葉酸(1日XNUMX mg)、アスコルビン酸(XNUMX日XNUMX gまで)。 必要に応じて、補充療法は酵素製剤(メジムフォルテ、フェスタル、エンジスタル、クレオン、パンシトレート、アシジンペプシン)で行われます。 疼痛症候群は通常、中程度の治療用量の制酸剤(マーロックス、アルマゲル、胃)またはH-ヒスタミン受容体遮断薬(ラニチジン、ファモチジン)の指定によって停止されます。 特殊な形態の胃炎では、基礎疾患の治療が必要です。 予後と予防。人生と仕事の予後は良好です。慢性胃炎の患者は消化器科医に登録する必要があります。腫瘍の形質転換を排除するために、少なくとも年に 1 回は生検による臨床検査および内視鏡検査が行われます。癌性変性の観点から最も危険なのは、上皮異形成を伴う肥厚性びまん性萎縮性胃炎です。 出血を伴う侵食性疾患、およびメネトリエ病の非代償性形態では、予後は外科的治療の適時性と妥当性によって決定されます。 胃炎の予防は、合理的な栄養、仕事と休息の体制の順守、NSAIDの摂取の制限に還元されます。 レクチャーNo.11。消化管の病気。 胃の病気。 消化性潰瘍 消化性潰瘍(消化性潰瘍)は慢性の再発性疾患であり、臨床的には胃十二指腸領域の機能的病理によって、そして形態学的には - その粘膜および粘膜下層の完全性の侵害によって現れるため、潰瘍は常に傷。 病因。消化性潰瘍疾患の主な病因は、胃上皮の表面での HP の微生物の増殖です。 病気の病因における細菌攻撃の重要性は、1983 年に J. Warren と B. Marshall が胃の洞の上皮の表面に多数の S-らせん菌を発見したことを報告して以来研究されてきました。 ヘリコバクテリアは、(血流からの)尿素をアンモニアと二酸化炭素に変換するウレアーゼ酵素の産生により、酸性環境に存在することができます。 酵素加水分解の生成物は塩酸を中和し、各細菌細胞の周囲の環境の pH を変化させる条件を作り出し、微生物の生命活動にとって好ましい条件を提供します。 総 HP コロニー形成は、ホスホリパーゼの作用による上皮の損傷を伴う胃上皮細胞の表面で発生します。 後者は、胆汁からの有毒なレシチンとプロテイナーゼの形成を提供し、保護タンパク質複合体と粘液の破壊を引き起こします。 上皮細胞の膜がアンモニアで「アルカリ化」することを背景に、細胞の膜電位が変化し、水素イオンの逆拡散が増加し、胃粘膜の上皮の死と落屑が起こります。 これらすべての変化は、胃粘膜の深さへのHPの浸透につながります。 消化性潰瘍の発症において同様に重要なのは、精神神経への影響、遺伝的素因、感染因子、消化不良、特定の薬の摂取、および悪い習慣です。 バーグマンは、自律神経系の遺伝性体質障害が胃壁の筋肉と血管のけいれん、虚血、および胃の減少につながると主張しました。胃液の攻撃的な影響に対する粘膜の抵抗性。 この理論は、K. N. Bykov と I. T. Kurtsin (1952) によってさらに展開されました。 彼らは、慢性神経精神的外傷に起因する高次神経活動の変化に関するデータに基づく、潰瘍形成の皮質内臓理論を立証しました。 胃の分泌、運動性、および栄養の調節における生化学的およびホルモンのリンクの教義によって補足および詳細化されたこの潰瘍形成の理論は、近年再び多くの支持者を獲得しています. 研究者の間で人気があるのは遺伝的要因です:主な神経プロセスの慣性、血液のグループ固有の特性、免疫学的および生化学的特徴、遺伝的負担症候群。 消化性潰瘍の発生では、消化管の違反が本質的に重要視されていました。 しかし、過去 XNUMX 年間に実施された臨床研究および実験研究では、ほとんどの場合、胃十二指腸粘膜に対する食品の有害な影響は明らかにされていません。 さまざまな食習慣を持つ人々の重要な偶発集団における消化性潰瘍疾患の有病率も、栄養要因の主要な重要性を証明しています。 消化性潰瘍の発生には、栄養のリズムと規則性の乱れ、食事間の長い休憩、早すぎる食事が不可欠です。 研究者は、潰瘍形成におけるアルコールの役割について、比較的相反する見解を表明しています。 アルコールは、胃粘膜に萎縮性変化を引き起こすことが知られています。 これらの観察は、潰瘍形成の一般的な概念と矛盾しています。 しかし、アルコールの頻繁な使用は、食事療法の違反、食物の組成の質的変化を伴い、最終的には胃と十二指腸の消化性潰瘍を引き起こす可能性があります。 潰瘍形成における薬効の役割は、活発に研究されています。 文献に発表された研究結果と私たち自身のデータは、非ステロイド性抗炎症薬とグルココルチコイド ホルモンが最も顕著な潰瘍形成特性を持っていることを示しています。 病因。消化性潰瘍の病因はまだ完全には理解されていません。潰瘍形成のプロセスを考えるときは、次のようないくつかの仮説に焦点を当てる必要があります。 1) 消化性潰瘍の増悪の季節性を特徴とする; 2) 幽門十二指腸帯に消化性潰瘍の主な局在がある; 3)胃液中の塩酸とペプシンの存在が認められた。 4)胃潰瘍および十二指腸潰瘍の自然治癒の高頻度(最大70%)が顕著です。 5)HPに関連する慢性幽門洞胃炎があります。 6)胃の幽門部分と十二指腸の最初の部分は、消化管の「視床下部」です。 7)消化性潰瘍の発生に対する遺伝的素因があります。 8)潰瘍の発生、その再発および寛解は、上記のすべての要因の存在下で可能です。 したがって、潰瘍形成の統一された概念は次のとおりです。 秋または春の不整脈の期間中に慢性細菌性胃炎の存在下で消化性潰瘍の遺伝的素因を有する患者では、ガストリン、ヒスタミン、メラトニンおよびセロトニンを分泌する内分泌細胞の過形成および機能亢進のみが認められる。 人体ピロル十二指腸ゾーンによって生成される主なホルモンと生体アミンは、主にこのゾーンで、胃液分泌の刺激と栄養および細胞増殖の変化の両方に関与しています。 活動性の細菌性胃炎および十二指腸炎を背景に、潰瘍形成に好ましい状態が生じる。 消化性潰瘍の形成に伴い、内分泌細胞の機能的活動が低下します。 これにより、酸消化性潰瘍の減少、人体ピロロ十二指腸帯の組織栄養の改善、および進行中のHPの微生物増殖を背景としても、胃潰瘍および十二指腸潰瘍の治癒条件の作成につながります。 消化性潰瘍の急性期には、普遍的な細胞保護剤であるα-エンドルフィン産生細胞の過形成が認められます。 それらは消化性潰瘍の主要な保護メカニズムとして機能し、直接および免疫系を刺激することによって、潰瘍の自己制限とその治癒のプロセスを提供します。 同時に、胃と十二指腸の粘膜下組織で合成されたHPに対する抗体は、細菌細胞に効果的に結合し、HP毒素を中和し、それらの死に寄与します。 上記のすべては、いわゆる攻撃性の要因と保護の要因と胃十二指腸帯の消化性潰瘍の治癒との間のバランスの作成に貢献します。 分類。分類 (Panfilov Yu. A.、Osadchuk M. A.、1991) 消化性潰瘍の局在: 1)胃潰瘍(心臓下および心臓セクション、幽門部分および幽門管、小弯および大弯); 2) 十二指腸潰瘍 (球部および球後部); 3)胃と十二指腸の潰瘍。 消化性潰瘍の経過。 1.簡単。 潰瘍の悪化は1〜1年に3回以下であり、消化性潰瘍の治癒は治療開始から5〜6週までに終了し、痛みと消化性潰瘍症候群の重症度は中程度です。 2.中程度。 年に少なくとも2回の再発、潰瘍の上皮化 - 7〜12週間以内に、痛みと消化不良症候群の重症度。 3.重い。 寛解期間は3〜4か月を超えません。 激しい痛みに加えて、合併症があります。 病気の段階: 1)胃十二指腸系の潰瘍再発または機能障害の悪化; 2)完全寛解(臨床的、放射線学的、内視鏡的および機能的側面において); 3)不完全(胃十二指腸ゾーンの機能的または構造的障害の保存を伴う)。 胃と十二指腸の粘膜の状態: 1)慢性胃炎; 2) 慢性十二指腸炎。 胃十二指腸系の機能状態 分泌:正常、増加、減少。 運動性: 通常、加速、低速。 避難:正常、加速、遅延、十二指腸静止。 合併症:出血、穿孔、浸透、胃周囲炎、十二指腸周囲炎、胃と十二指腸の瘢痕性変形。 臨床画像。消化性潰瘍の臨床像は多形性です。症状は、患者の性別と年齢、時期、潰瘍の位置と大きさ、患者の個人的および社会的特徴、および専門的資質によって異なります。クリニックは症状の組み合わせによって決定されます:発症の瞬間からの病気の慢性経過、病気の増悪と寛解の兆候の存在、胃および十二指腸粘膜の欠損の治癒と胃粘膜の形成。傷跡。 消化性潰瘍は、胃潰瘍と十二指腸潰瘍の XNUMX つの臨床的および形態学的変異によって表されます。 伝統的に、痛みと消化不良症候群は区別されています。 主な臨床徴候は上腹部の痛みです。 疼痛症候群の性質上、慢性細菌性胃炎と消化性潰瘍を区別することはほとんど不可能です。 主に春と秋に、空腹時の心窩部領域の痛みは、消化性潰瘍と慢性細菌性胃炎の両方で同様に一般的です。 慢性細菌性胃炎と消化性潰瘍の両方で、食物と薬用制酸剤による疼痛症候群の緩和が達成されます。 十二指腸潰瘍の特徴は、夜間に上腹部に痛みがあることだけです。 消化性潰瘍を伴う嘔吐はまれです。 吐き気は、胃潰瘍や十二指腸潰瘍でより一般的です。 便秘は慢性十二指腸潰瘍を伴います。 消化性潰瘍疾患の症状は、潰瘍性欠陥の数とその局在によって決まります。 複数の胃潰瘍は男性で3倍一般的です。 この場合の臨床像は、消化性潰瘍の局在に依存します。 胃の体に潰瘍があり、照射なしでみぞおちに鈍い痛みがあり、これは食事の20〜30分後に発生し、吐き気が見られます。 心臓下部の潰瘍では、剣状突起の下で胸の左半分に放射状に広がる鈍い痛みが特徴的です。 胃潰瘍と十二指腸潰瘍の合併は、活動性の胃潰瘍と治癒した十二指腸潰瘍の組み合わせです。 それらは、疼痛症候群の長期保存、病気の持続的な経過、病気の頻繁な再発、潰瘍のゆっくりとした瘢痕化、および頻繁な合併症によって特徴付けられます。 球外潰瘍には、球十二指腸括約筋の領域に位置し、その遠位にある潰瘍が含まれます。 彼らの臨床像には独自の特徴があり、十二指腸潰瘍と多くの共通点があります。 それらは主に40-60歳の患者に発生します。 球根後潰瘍は重度であり、大量の出血を伴う頻繁な悪化を起こしやすい。 腹部の右上腹部に限局し、背中または右肩甲骨の下に広がる痛みは、100%の症例で発生します。 麻薬性鎮痛薬を服用した後にのみ治まる痛みの強さ、重症度は、患者を重度の神経衰弱に導きます。 球外潰瘍の悪化の季節性は、患者のほぼ90%で記録されています。 多くの患者では、胃腸出血が主要な症状になります。 幽門管の潰瘍は、幽門症候群と呼ばれる症状の複合体によって特徴付けられます。心窩部痛、吐き気、嘔吐、および大幅な体重減少です。 病気の悪化は非常に長いです。 集中的な抗潰瘍治療を背景に、潰瘍は3か月以内に瘢痕化します。 幽門管への豊富な血液供給は、大量の胃出血を引き起こします。 診断法。消化性潰瘍の合併症のない経過では、一般的な血液検査に変化はありませんが、ESR のわずかな低下とわずかな赤血球増加が発生する可能性があります。血液検査で合併症が発生すると、貧血、白血球増加症が現れます - 腹膜が病理学的過程に関与している場合。 尿の一般的な分析に変更はありません。 消化性潰瘍の複雑な経過の場合の血液の生化学的分析では、シアルテスト、C反応性タンパク質、DPA反応のパラメーターの変更が可能です。 胃の病理学における伝統的な研究方法は、胃内容物の酸性度の測定です。 さまざまな指標が考えられます。上昇したものと正常なもの、場合によっては減少したものもあります。 十二指腸潰瘍は、胃液の酸性度が高い状態で発生します。 X線検査では、消化性潰瘍は「ニッチ」、つまりバリウム懸濁液の貯蔵所です。 このような直接的なレントゲン写真の症状に加えて、消化不良の間接的な兆候が診断において重要です。空腹時の胃の内容物の過剰分泌、避難障害、十二指腸逆流、心臓機能障害、局所痙攣、粘膜ひだの収束、胃と十二指腸の瘢痕性変形。 生検を伴う胃十二指腸鏡検査は、消化性潰瘍を診断するための最も信頼できる方法です。 これにより、潰瘍の縁、潰瘍周囲の粘膜の変化の性質を評価することができ、形態学的レベルでの診断の正確性が保証されます。 内視鏡的および形態学的研究では、ほとんどの胃潰瘍が小弯および前庭部の領域に位置し、それほど頻繁ではありません - 大弯および幽門管の領域に位置することがわかりました。 十二指腸潰瘍の 90% は球部に位置しています。 消化性潰瘍は通常、円形または楕円形です。 その底は壊死塊で構成されており、その下には肉芽組織があります。 底に黒い斑点がある場合は、出血を示しています。 潰瘍治癒期は、粘膜の充血の減少と潰瘍周囲の炎症性シャフトによって特徴付けられます。 欠損の深さが浅くなり、線維性プラークが徐々に除去されます。 瘢痕は、壁の線状または星状の収縮を伴う粘膜の充血領域のように見えます。 将来、元の潰瘍の部位での内視鏡検査中に、粘膜の緩和のさまざまな違反が特定されます:変形、瘢痕、狭窄。 内視鏡検査では、肉芽組織による欠陥の置換による成熟した瘢痕は白っぽい外観をしており、活発な炎症の兆候はありません。 潰瘍の底部と縁から得られた生検標本の形態学的研究は、腐敗した白血球、赤血球、およびその下にあるコラーゲン線維を伴う剥離した上皮細胞の混合物を伴う粘液の蓄積の形で細胞の破片を明らかにします。 差動診断。内視鏡検査の普及により、胃および十二指腸の潰瘍(症候性潰瘍、結核における特異的潰瘍、梅毒、クローン病、原発性潰瘍性癌、続発性悪性潰瘍)の鑑別診断が特に重要になっています。 症候性潰瘍の場合、それらを引き起こした原因がなければなりません(極端な曝露、内分泌疾患の臨床的および形態学的兆候、心血管および呼吸器疾患、リウマチ性疾患)。 消化性潰瘍よりも、病変の多様性、胃の主な局在、およびかなりのサイズが特徴です。 消化性潰瘍では、痛み症候群が蔓延し、慢性胃炎では消化性消化不良の現象が見られます。 慢性胃炎では、痛みは軽度または欠如しており、病気の季節性はなく、触診での痛みは限られています。 病気の悪化はしばしば食物の性質に依存します。 胃炎を伴う胃の分泌機能の状態は異なる場合があります。 決定的に重要なのは胃内視鏡検査と胃生検であり、胃炎に特徴的な粘膜の変化と消化性潰瘍の潰瘍が検出されます。 裂孔ヘルニア(HH)は、上腹部の痛みも伴うことがよくあります。 しかし、消化性潰瘍とは異なり、この病気は主に患者の高齢、痛みと体位との関係(仰臥位で痛みが増し、直立位で弱くなる)が特徴です。 HH の診断は、X 線検査の結果によって確認されます。 慢性胆嚢炎は、右季肋部とみぞおちの痛みを特徴とし、多くの場合、右肩甲骨、肩、右下顎の角度に放射状に広がります。 結石性胆嚢炎では、鈍く、単調で、圧迫感があり、結石性胆嚢炎では、疝痛の特徴を獲得します。 吐き気、便秘、鼓腸が見られます。 持続的な亜熱性状態が可能です。 胆管の閉塞が長引くと、黄疸が加わることがあります。 胆道系の損傷の診断は、腹部超音波検査、X線検査(胆嚢造影)、内視鏡的逆行性胆膵造影(ERCP)のデータ、および石のないプロセスでのみ示される十二指腸サウンディングの結果によって検証されます。 急性膵炎および慢性疼痛の悪化では、それらは心窩部領域の左半分に局在し、本質的に帯状疱疹であり、食物の摂取によって引き起こされます。 既往歴 - 胆道系の病理学、アルコール乱用、膵臓薬の長期使用。 客観的に減量、ポリフェカル、脂肪便、クリエーターを明らかにします。 診断は、膵臓酵素、糞便の消化率に関する生化学的血液検査の結果、および機器データによって確認されます。 治療。消化性潰瘍の合理的な治療には、養生法、適切な栄養補給、薬物治療、心理療法、理学療法、温泉治療法が含まれるべきです。消化性潰瘍疾患の悪化の期間中は、分割食(4日6〜120回、特定の時間に少量の食物を摂取する)を厳密に観察する必要があります。食品には優れた緩衝特性があり、十分なタンパク質 (140 ~ XNUMX g) が含まれている必要があります。 心理療法は、持続性疼痛症候群とその期待から生じる精神神経反応を停止または軽減するために不可欠です。 消化性潰瘍の治療に使用される薬は、次の 5 つのグループに分けられます。 1) 酸消化因子に影響を与える薬剤 (制酸剤および H2ヒスタミンブロッカー、その他の抗分泌剤); 2)胃粘膜バリアを改善する薬; 3) 内因性プロスタグランジンの合成を増加させる薬; 4)抗菌剤および防腐剤; 5) 胃と十二指腸の運動排泄障害を正常化する薬。 制酸剤: 1)可溶性(吸収性) - 重炭酸ソーダ、炭酸カルシウム(チョーク)および酸化マグネシウム(焼いたマグネシア); 2)不溶性(非吸収性):三ケイ酸マグネシウムと水酸化アルミニウム。 可溶性制酸薬は、即効性があり、強力ですが、短期間のアルカリ化効果がありますが、しばしば副作用を引き起こすため、消化性潰瘍の治療には使用されません。水酸化アルミニウムと水酸化マグネシウムをベースとした不溶性制酸剤(アルマゲル、フォスファルーゲル、ゲルシラック、トパール、マロックスなど)は、塩酸を長期にわたって中和し、粘膜を包み込み、酸や食物の有害な影響から粘膜を保護します。塩酸を中和することに加えて、それらは胃液のタンパク質分解活性を低下させ、リゾレシチンと胆汁酸を結合し、普遍的な細胞保護効果をもたらします。 制酸剤は、食後 1 ~ 2 時間および夜間に服用する必要があります。 Maaloxは、懸濁液(15mlを4日1回)または錠剤(2〜4錠を16日3回)、ホスファルゲル(ゲルの形で4gをXNUMX日XNUMX〜XNUMX回)で処方されます。 非吸収性制酸剤の主な副作用の XNUMX つは、便障害です。 水酸化アルミニウム製剤は便秘を引き起こし、水酸化マグネシウム製剤(マーロックス)は用量依存的な下剤効果があります。 Hの登場により消化性潰瘍治療の新時代が幕を開けた2-ヒスタミン遮断薬。 生理学的条件下で、ヒスタミンは酸産生を引き起こす胃外神経および体液性刺激を媒介します。 ヒスタミンによる塩酸産生の刺激は、胃の酸産生領域に含まれる酵素アデニルシクラーゼに作用するcAMPの活性の増加によるもので、水素イオンの分泌を促進します。 得られたデータは、シメチジン、ラニチジン、ファモチジン、ニザチジンなど、細胞レベルでの分泌プロセスへのヒスタミンの関与を妨げる薬物の合成の基礎でした。さらに、H2ヒスタミン受容体は、胃粘膜の微小循環障害を防ぎ、潰瘍の発生を防ぎます。 さらに、それらはペプシンの産生を減らし、重炭酸塩の分泌を増やし、胃十二指腸運動を正常化し、DNA合成上皮細胞の数を増やし、修復プロセスを刺激し、慢性胃潰瘍と十二指腸潰瘍の治癒を加速します。 しかし、第 1 世代の薬剤 (シメチジン、シナメット、ベロメット、タガメット) は、神経系の変化、中毒性肝炎、心血管系のリズムと伝導障害、および造血器官の変化を引き起こす可能性があります。 Hブロッカー2次世代のヒスタミン受容体-ラニチジン(ザンタック、ラニサン、ギスタク)、ファモチジン(クバマテル、レセジル、ガストロシジン)、ニザチジン(ロキサチジン)は、シメチジンとは耐性が異なります。 ラニチジンは150日2回20mg、ファモチジン - 2mgを4日6回、150〜20週間処方されています。 潰瘍治癒後の離脱症候群を予防するために、夜間にラニチジン(2 mg)またはファモチジン(3 mg)をXNUMX〜XNUMXか月間服用し続けることをお勧めします. 近年、ベンゾイミダゾール誘導体に属する新しい抗分泌薬オメプラゾール(オメンロール、オメズ、ロセック)が登場しました。 壁細胞のプロトンポンプの酵素 H + -K + -ATPase をブロックします。 半減期が短く(約1時間)、作用持続時間が長い(18~24時間)ため、20回の服用で十分です。 オメプラゾールは、夜間に 1 mg を 2 日 3 回、XNUMX ~ XNUMX 週間処方されます。 オメプラゾールは、現代の抗潰瘍薬の中で抗分泌作用の重症度で第 XNUMX 位であり、副作用はそれほど顕著ではありません。 消化性潰瘍の治療における広範な使用により、抗コリン作動薬に属するガストロセピン(ニレンゼピン、ガストロゼピン)が発見されました。 この薬は、塩酸とペプシンを生成する胃粘膜の細胞にあるムスカリン性アセチルコリン受容体を選択的に遮断します。 ガストロセピンは、胃の基礎および刺激された分泌に対して阻害効果があり、ペプシンの産生を阻害し、胃からの排泄を遅らせ、ガストリン産生の阻害を引き起こし、膵臓ポリペプチドのレベルを低下させ、胃粘液糖タンパク質の産生を増加させることにより細胞保護効果を有する、および胃十二指腸領域の粘膜への血液供給を改善することによって。 食事の 50 分前に 2 日 30 回 4 mg に割り当てます。 治療の経過は平均XNUMX週間です。 胃の粘膜バリアを強化する薬には、粘膜に保護膜を形成し、胃の消化活動を低下させ、ペプシンと不溶性化合物を形成し、粘液の形成を促進し、細胞保護作用のあるコロイドビスマス(デノール)の製剤が含まれます。胃壁内のプロスタグランジンの含有量を増加させる効果があります。デノールは胃粘膜におけるHPの活性を阻害する能力を持っています。この薬は、2錠(240 mg)を2日2回、食事の8分前または食事のXNUMX時間後に処方されます。体内のビスマス塩の蓄積を避けるために、これらの薬をXNUMX週間以上使用して治療を行うことはお勧めできません。胃潰瘍や十二指腸潰瘍の抗菌治療には、テトラサイクリン、アモキシシリン、クラリスロマイシンが使用されます。他の抗潰瘍薬と併用して使用されます。 併用療法 (XNUMX、XNUMX、XNUMX 成分) のいくつかのスキームが提案されています。 二成分療法:アモキシシリン1000mgを2日2回、40週間。 オメプラゾール2mgを120日4回。 250成分スキームには、コロイド状ビスマス4 mgを250日4回調製することが含まれます。 テトラサイクリン 14 mg を XNUMX 日 XNUMX 回。 メトロニダゾールXNUMXmgをXNUMX日XNUMX回。 治療サイクルはXNUMX日です。 20成分スキームには、2日目から1日目まで10日120回、オメプラゾール4mgが含まれます。 de-nol 4 mg を 10 日目から 500 日目まで 4 日 4 回。 テトラサイクリン 10 mg を 500 日目から 3 日目まで 4 日 10 回。 メトロニダゾール6mgを93日目から96日目までXNUMX日XNUMX回。 胃および十二指腸の消化性潰瘍の治療のためのXNUMX成分スキームは、最も効果的であると認識されています。 その XNUMX 週間後、患者の XNUMX ~ XNUMX% で消化不良の治癒が観察されます。 胃と十二指腸の消化性潰瘍の瘢痕化の後、XNUMX種類の治療法が伝統的に使用されています。 1) 持続的な維持療法は、抗分泌薬を XNUMX 日量の半分で最長 XNUMX 年間行います。 2) 治療「オンデマンド」では、消化性潰瘍の症状が現れたときに、抗分泌剤の XNUMX つを XNUMX 日量の半分で XNUMX 週間使用します。 予後と予防。合併症のない病気は、生活や仕事の予後が良好です。消化性潰瘍疾患の合併症の場合、予後は外科的ケアの適時性によって決まります。 消化性潰瘍の再発の予防には、年に2回の医師による必須のフォローアップ検査による動的モニタリングが含まれます。 検査には、臨床検査と内視鏡検査、および必要に応じて形態学的検査を含める必要があります。 予防策として、睡眠と休息を正常化し、悪い習慣をやめ、潰瘍性薬剤の摂取を制限し、3日XNUMX食を合理的に摂取し、XNUMXまたはXNUMX成分療法をXNUMXか月ごとにXNUMX週間使用することをお勧めします. LECTURE No. 12.消化管の病気。 腸の病気。 小腸の病気。 慢性腸炎 慢性腸炎は、小腸の粘膜の炎症、萎縮、硬化の発症に至る、ジストロフィーおよびジスリジェネレーションの変化を背景としたその機能(消化および吸収)の違反を特徴とする小腸の疾患です。 病因と病因。これは、小腸の急性炎症または原発性の慢性過程の結果である可能性がある多因性疾患です。 近年、エルシニア、ヘリコバクテリア、プロテウス、緑膿菌、ロタウイルス、原生動物および蠕虫の多数の代表(ジアルジア、回虫、条虫、カイチュウ、クリプトスポリジウム)が慢性腸炎の病因として非常に重要になっています。 慢性腸炎の発生において非常に重要なのは、過食、乾燥食品の摂取、バランスの取れていない、主に炭水化物食品、香辛料の乱用などの栄養要因です。 腸炎は、電離放射線、有毒物質への曝露、および薬物によって引き起こされます。 小腸の慢性疾患の一般的な発症機序の中で、局所免疫および全身免疫の低下を背景に、腸内細菌叢に変化があります。 免疫状態の変化 - 分泌型 IgA の含有量の減少、IgE レベルの増加、リンパ球の芽球形質転換の減少、および白血球遊走の阻害 - は、日和見微生物叢の代表者による小腸のコロニー形成につながります。正常な嫌気性フローラの減少。 小腸での細菌のコロニー形成は、上皮細胞の cAMP の活性化により腸の分泌を高めます。これにより、腸の透過性が高まり、細胞による電解質と水の産生が促進されます。 水と電解質の分泌は、水と塩の代謝の違反につながります。 微生物叢の影響下で、胆汁の腸肝循環が妨げられます。 脂肪酸はカルシウムイオンと結合し、糞便中に排泄される難溶性石鹸を形成します。 カルシウム代謝の違反は、カルシウムの吸収を低下させるビタミンDの代謝の変化によって促進されます。 脂溶性ビタミンの代謝障害の影響下で、血中の微量元素の含有量が減少します。 長期にわたる腸内細菌叢は、微生物および食物抗原に対する感作を促進し、粘膜の免疫炎症を引き起こし、その結果、組織抗原が形成されます。 粘膜バリアの透過性の増加は、アレルゲンとなる非分割タンパク質高分子の再吸収を伴い、免疫学的反応性が損なわれます。 アレルギーでは、腸壁の透過性を高め、腸細胞の機能特性を変化させる生物学的に活性な物質が放出されます。 腸細胞の細胞質膜の微細構造に違反すると、最初にラクターゼ活性が阻害され、次にマルターゼおよびスクラーゼ活性が阻害されます。 上皮細胞のジストロフィー、再生不全の変化により、酵素の合成と上皮細胞の膜への吸着(二糖類、ペプチダーゼ、エンテロキナーゼ、アルカリホスファターゼ)が減少し、膜と腔の両方の消化に障害を引き起こします。 これらすべてが吸収不良症候群の基礎となります。 疾患の初期段階では、脂肪吸収の減少、糞便による脂肪の喪失、および腸肝胆汁循環の腸相の変化により、脂質代謝障害が発生します。 胆汁代謝の違反は、次に、脂質代謝の破壊につながり、それは細胞膜の構造と機能に影響を及ぼします。 脂肪の吸収が不十分であることに関連して、ステロイドの合成の違反が起こり、それは内分泌腺の機能の違反を引き起こします。 形態学的には、慢性腸炎は、小腸の粘膜における炎症性および再生不全の変化によって現れる。 プロセスが進行すると、その萎縮と硬化が観察されます。 分類 (Zlatkina A. R.、Frolkis A. V.、1985)。 1) 病因: 腸の感染症、蠕虫の侵入、消化器、物理的および化学的要因、胃、膵臓、胆道の病気。 2) 疾患の段階: 増悪; 寛解。 3)重症度:軽度; 適度; 重い。 4) 現在: 単調。 再発; 継続的に繰り返されます。 潜在的な。 5) 形態学的変化の特徴: 萎縮のない単位。 中等度の部分的な絨毛萎縮を伴う jeunitis; 部分的な絨毛萎縮を伴う子宮炎; 完全な絨毛萎縮を伴う。 6)機能障害の性質:膜消化障害(ジサッカリダーゼ欠損症)、水の吸収不良、電解質、微量元素、ビタミン、タンパク質、脂肪、炭水化物。 7) 合併症: ソラリチス、非特異的メサデニ炎。 臨床画像。慢性腸炎の臨床像は、局所的および全身的な腸症候群で構成されます。 1つ目は、頭頂部(膜)および腔の消化プロセスの違反(消化不良)によって引き起こされます。患者は鼓腸、臍傍領域の痛み、帽子状の膨満感、大きなゴロゴロ音、下痢、およびまれに便秘を訴えます。触診により、腹部中膜の痛み、およびへその左側および上部の痛み(ポルジェス徴候陽性)、盲腸の領域での飛び散るノイズ(オブラスツォフ徴候)が明らかになります。糞便は粘土状の外観を呈し、複数の糞便が特徴的です。 一般的な腸症候群は、食物成分の吸収障害(吸収不良)に関連しており、あらゆる種類の代謝障害、恒常性の変化をもたらします。 多面的な代謝障害、主にタンパク質を特徴とし、進行性の体重減少によって現れます。 炭水化物代謝の変化はそれほど顕著ではなく、乳製品を摂取している間の膨満感、腹部のゴロゴロ音、下痢の増加によって現れます. 患者の体重減少の大部分は、タンパク質だけでなく脂質の不均衡にも起因しています。 脂質代謝の変化は、脂溶性ビタミンやミネラル(カルシウム、マグネシウム、リン)の代謝異常と密接に関係しています。 カルシウム欠乏症の特徴的な兆候は、マッスルローラーの陽性症状、痙攣、再発性の「動機のない」骨折、骨粗鬆症、骨軟化症です。 顔の腫れ、唇のチアノーゼ、舌炎、過敏症、睡眠不足もあります。 水分と電解質のバランスの乱れは、全身の衰弱、運動不足、筋肉の低血圧、吐き気、嘔吐、および中枢神経系の変化によって現れます。 ビタミン欠乏症の症状は、中等度から重度の慢性腸炎に典型的になります。 低ビタミンC症は、歯茎の出血、繰り返される鼻出血、子宮出血、皮膚のあざによって臨床的に現れます。 ビタミンB欠乏症には、皮膚の蒼白、舌炎、口角炎(cheilez)が伴います。 脂溶性ビタミン (A、O、E、K) の欠乏の徴候: 薄明視力の低下、皮膚と粘膜の乾燥、歯茎の出血の増加。 重度の慢性腸炎は、内分泌機能障害(多発腺不全)の症状を伴います。 皮質機能低下症は、動脈性低血圧、心不整脈、食欲不振、および皮膚の色素沈着によって現れます。 生殖腺の活動の低下は、卵巣機能障害、月経障害、男性のインポテンス、女性化乳房、脱毛を伴います。 甲状腺機能障害は、全身の脱力感、皮膚の乾燥、徐脈、パフォーマンスの低下、および知的記憶障害を特徴としています。 診断と鑑別診断。一般的な血液検査では、小球性および大球性貧血、ESRの増加、さらに重篤な場合にはリンパ球減少および好酸球減少が明らかになります。病気が寄生虫由来の場合、血液中にリンパ球増加症や好酸球増加が観察されることがあります。 スカトロロジー検査は、脂肪酸と石鹸による腸型脂肪便、クリエーターレア、アミロレアを明らかにします。 糞便中のエンテロキナーゼとアルカリホスファターゼの含有量が増加します。 毎日の糞便の量は大幅に増加します。 糞便の細菌学的分析は、さまざまな程度の異菌症を明らかにします。 ラクトバクテリアおよびビフィズス菌、腸球菌、酵素特性が変化した大腸菌の菌株が減少しています。 重度の慢性腸炎における尿の一般的な分析では、微量アルブミン尿および微小血尿が認められます。 生化学的血液検査では、低タンパク血症、低アルブミン血症、低グロブリン血症、低カルシウム血症、マグネシウム、リン、その他の微量元素のレベルの低下、ナトリウムとカリウムのレベルの低下という形の電解質代謝障害が検出されます。 脂質代謝障害には、脂質スペクトルの変化が伴います。コレステロール、リン脂質のレベルが低下し、胆汁酸、リン脂質、およびトリグリセリドのスペクトルも変化します。 X線研究の結果により、小腸の運動機能と粘膜の緩和、硫酸バリウム懸濁液の小腸通過の減速または加速の形でのジストニアおよびジスキネジーの変化を明らかにすることができます腸、および粘膜のレリーフは、ひだの不均一な肥厚、変形および平滑化の形で変化します。 胃十二指腸内視鏡検査では、萎縮性胃炎と十二指腸炎が明らかになります。 軽度の慢性腸炎の形態学的画像は、絨毛の肥厚、それらの変形、ノッチの深さの減少、平滑筋の緊張の減少、上皮下浮腫、上皮表面の変性変化によって特徴付けられます、細胞の刷子縁の菲薄化、絨毛領域の杯細胞数の減少、陰窩数の増加、およびそれ自体の層の浸潤 リンパ形質細胞要素を伴う粘膜、パネート細胞の減少陰窩の底の領域。 中等度の形態では、絨毛の部分的な萎縮、陰窩の数の減少、粘膜の薄化、刷子縁の減少、および粘膜下層と筋層のリンパ形質細胞浸潤が典型的です。 疾患の重症型は、組織学的、組織化学的、および形態計測的基準によって診断された進行性絨毛萎縮を特徴とする。 腸細胞の増殖過程はそれらの分化よりも優勢であり、未成熟で欠陥のある細胞が豊富に現れます。 慢性腸炎の鑑別診断は、セリアック病、クローン病、ホイップル病、腸アミロイドーシス、憩室疾患、リンパ腫、小腸の腫瘍で行われます。 これらすべての症状に共通するのは、消化不良、吸収障害、および細菌異常症の臨床症候群です。 最終的な診断は、小腸の粘膜の形態学的検査によって確認されます。 したがって、セリアック病については、グリアジン含有製品の使用による病気の悪化の関係の既往歴が典型的です. セリアック病の診療所は慢性腸炎に似ています。 ほとんどの場合、腸の上部が影響を受け、回腸に変化はありません。 生検標本を採取するのに最適な部位は、トライツ靭帯近くの粘膜の領域です。 形態学的検査では、杯細胞の数の減少と上皮間リンパ球の数の増加、亜全絨毛萎縮、およびそれ自体の層の炎症細胞浸潤が明らかになります。 セリアック病では、形態学的変化が不可逆的である平凡な慢性腸炎とは対照的に、グルテンを含まない食事の背景にある形態学的変化は可逆的です。 クローン病では、疾患の自己免疫発生とその特徴的な全身症状(自己免疫性甲状腺炎、多発性関節炎、虹彩炎、肝炎、腸炎と遠位大腸炎の頻繁な組み合わせなど)により、臨床的多型が認められます。 内視鏡検査および形態学的検査は、クローン病の検証において高解像度であり、腸病変のモザイク性、無傷の粘膜の領域と交互になる「石畳舗装」タイプの典型的な変化を明らかにします。 X線、内視鏡検査は腸の狭窄を検出することができ、時には腸の瘻孔が形成されます。 形態学的診断は、粘膜下層への最大の損傷と粘膜の最小の変化を伴う腸壁のすべての層の炎症性細胞浸潤を述べています。 粘膜下層には、この疾患の病因であるリンパ球性サルコイド様肉芽腫が見られます。 ウィップル病では、腸炎の兆候に加えて、発熱、関節炎、リンパ節腫脹、動脈性低血圧、皮膚の色素沈着などの腸外症状が特徴的です。 病気の最も有益な形態学的基準。 小腸から採取した生検標本は、小腸粘膜および腸間膜リンパ節における細胞内および細胞外の脂肪蓄積を明らかにします。 CHIC陽性の無脂肪顆粒を含む大きなマイクロファージによるそれ自体の層の浸潤、および粘膜における桿菌の存在。 治療。慢性腸炎の治療は、病気の局所的および全身的な症状だけでなく、病因因子、発病メカニズムに影響を与える薬剤も含めて包括的である必要があります。 基本は、腸腔内の浸透圧の上昇を減らし、分泌を減らし、腸内容物の通過を正常化するのに役立つ食事栄養です。 粗い植物繊維を含む製品を除外する (生野菜、果物、ライ麦パン、ナッツ、ペストリー、缶詰食品、スパイス、スパイシーな料理、全乳、ビール、クワス、炭酸飲料、アルコール飲料)。 食卓塩の使用は制限されています。 5 日 6 ~ 100 回までの分数の食事が必要です。 寛解期には、200日あたり最大XNUMX〜XNUMX gの野菜や果物が食事に取り入れられます。 レタス、熟した皮をむいたトマト、柔らかい梨、甘いリンゴ、オレンジ、みかん、ラズベリー、イチゴ、野生のイチゴを割り当てます。 食べ物は煮るか蒸す必要があります。 薬物療法は、不変性、病因性、対症療法的である必要があります。変屈性治療:グレード II ~ IV の腸内細菌叢異常の場合、抗菌薬が処方されます:メトロニダゾール(0,5 g 3 日 0,5 回)、クリンダマイシン(4 g 0,5 日 2 回)、セファレキシン(0,48 g 2 日 1 回)、3 日)、ビセプトール( 4gを0,1日4回)、スルギン(5gを3日30〜3回)、フラゾリドン(3gを40日3回)。抗菌薬を使用した後、ユービオティックスが処方されます-ビフィズスバクテリンまたはビフィコールを3日3回、食事の20分前に3回投与、コリバクテリンまたはラクトバクテリンを15回食事前に20日20回、ヒラックフォルテ3滴を2日3回、食事前に投与します。細菌製剤による治療は長期間行われます:毎年XNUMXか月のXNUMXコース。ブドウ球菌性細菌性細菌症の場合、抗ブドウ球菌性バクテリオファージが処方されます(XNUMXml、XNUMX日XNUMX回、XNUMX〜XNUMX日間)、プロテウス性細菌性細菌症の場合、コリプロテアンバクテリオファージ、経口、XNUMXml、XNUMX日XNUMX回、治療コースはXNUMX〜XNUMX週間です。 止瀉薬として、イモジウム(ロペラミド)を1カプセル2日3〜3回、食前に5〜XNUMX日間処方します。 消化プロセスを改善するために、酵素が推奨されます:パンクレアチン、パンジノームフォルテ、フェスタル、ダイジェスタル、パンクルメン、メジムフォルテ、トリエンザイム、その用量は個別に選択されます(1日3回3錠から4日4回2〜3錠まで) )およびXNUMX〜XNUMXか月間、食事の直前または食事中に処方されます。 必要に応じて、酵素補充療法をより長期間続けます。 腸炎患者の全身状態を正常化し、代謝障害を排除するために、代替療法が適応となります。 ビタミンの不足を補うために、ビタミンBとBは4-5週間処方されます。6 各 50 mg、PP - 10 ~ 30 mg、C - 各 500 mg。 脂肪便に対しては、ビタミン B の非経口投与が適応となる。2 (100-200 mcg) 脂溶性ビタミンとの組み合わせ。 内部には、リボフラビンが0,02g、葉酸が0,003日3300回2g、ビタミンEが150日200回250IUで処方されています。 重度のタンパク質欠乏症を伴う慢性腸炎では、食事、血漿の非経口投与、500〜20mlのタンパク質加水分解物およびアミノ酸の混合物(アミノペプチド、アルベシン、ポリアミン、イントラフジン、2,0〜1mlを7日間静脈内投与)アナボリックホルモン(レタボリル10mlを3-4日にXNUMX回、XNUMX-XNUMX週間)およびイントラリピッドなどの脂肪混合物との組み合わせ。 ステロイドの指定は、重大なタンパク質欠乏症、低タンパク質血症、副腎不全の存在でのみ示されます。 水と電解質の障害を修正するには、パナンギン20〜30ml、グルコン酸カルシウム10%10〜20mlを200〜400mlの等張液またはグルコース溶液に静脈内投与し、ポリイオン溶液「Disol」、「Trisol」、「Quartasol」を使用します。示された。 電解質溶液は、酸塩基状態と血中電解質レベルの制御下で10〜20日間静脈内投与されます。 予後と予防。ほとんどの場合、生命予後と労働能力は良好です。予後的に好ましくない兆候は、病気の継続的な再発経過、突然の大幅な体重減少、貧血、内分泌障害症候群(性欲の低下、月経困難症、不妊症)です。 慢性腸炎の予防は、胃十二指腸領域の急性腸感染症および付随する疾患のタイムリーな治療、食事の観察、X線および放射線療法中の細菌製剤の予防的投与にあります。 レクチャーNo.13。消化管の病気。 腸の病気。 クローン病 クローン病は、全身症状を伴う慢性腸疾患です。 その形態学的根拠は、消化管の肉芽腫性自己免疫性炎症です。 病因と病因。この病気の病因と病因は十分に研究されていません。最も一般的なのは、病気の発生に関する感染性と免疫性の概念です。近年、エルシニア属の微生物の病因学的役割に関する報告が発表されています。しかし、これらの微生物が病原体であるか共生生物であるかを判断することは困難です。同時に、腸内細菌叢の変化は病気の発症に重要な役割を果たします。 通常、病原性の兆候を伴う腸内細菌の同時増加を伴うビフィダム型細菌の減少。 自己免疫メカニズムは、病気の発症に役割を果たします。 クローン病では、腸組織に対して自己抗体 (IgC、IgM) が現れます。 疾患の形態学的基質は、粘膜下層で最初に発生し、腸壁の厚さ全体に広がり、肉芽腫性浸潤の存在とそれに続く粘膜の潰瘍形成、膿瘍の発生、および瘢痕の形成と腸管腔の狭窄で治癒する瘻。 病気の期間が長くなると、病変の範囲が広がり、腸外障害の症状が現れます。 分類。分類 (F.I. コマロフ、A.I. カザノフ、1992)。 1)コース:急性; 慢性。 2)プロセスの特徴:小腸内の病変; 回盲部内の病変; 結腸内の病変。 3)合併症:腸の狭窄; 結腸の有毒な拡張; 瘻孔; アミロイドーシス; 腎結石症、胆石症; で12・欠乏性貧血。 臨床画像。クローン病の臨床像は、腸内の病理学的過程の局在化と範囲、疾患の形態、および合併症の追加によって決定される、顕著な多様性によって特徴付けられます。 病気の発症は、病気が最初から進行するときは急性であり、病気が徐々に始まるときは慢性である可能性があります。 最初のケースでは、虫垂炎が疑われる開腹術、または若者に明らかな理由もなく発症した腸閉塞の際に診断が下されることがよくあります。 同時に、クローン病の特徴である小腸の高血症領域、腸間膜根の拡大したリンパ節が見つかります。 患者は、特定の局在化のない腹部の痛み、目に見える病理学的不純物のない便の緩み、体重減少、低体温を訴えます。 客観的な研究では、貧血の重症度、吸収障害による脚の腫れ、タンパク質代謝と相関する皮膚の蒼白に注意を払っています。 腹部の触診では、鼓腸とゴロゴロが見られます。 プロセスが大腸に限局している場合、便秘と下痢、けいれん性腹痛、血液の混合物を含む液体または半成形の便が交互に見られます。 上部消化管が冒されると、慢性食道炎、慢性胃炎、慢性十二指腸炎に似た症状が現れます。 食物が食道を通過する際の胸骨の後ろの痛み、夜、上腹部の「空腹」の痛み、幽門十二指腸帯の触診の痛みがあるかもしれません。 患者の身体検査中に、皮膚の蒼白、熱性下の状態、体重不足が決定され、触診により、右腸骨領域の傍臍帯の痛み、痙攣性腸ループが明らかになります。 クローン病では、アフタ性口内炎、口腔の蜂窩織炎および瘻孔、関節炎、クリニックの関節リウマチに似た、小関節の対称性病変、朝のこわばりの特徴的な症状を伴う、疾患の腸外徴候が認められます。 目の典型的な変化:虹彩毛様体炎、虹彩毛様体炎、黄斑症。 皮膚は結節性紅斑および壊疽性膿皮症を発症することがあります。 下痢は、便の頻度が10日XNUMX回以上、多量の糞便の増加によって特徴付けられます。 糞便の量は、プロセスの解剖学的局在化によって決まります。近位の小腸が損傷すると、糞便の量は遠位部分が損傷した場合よりもはるかに大きくなります。 すべての患者で体重減少が見られます。 診断と鑑別診断。増悪時の臨床血液検査では、白血球増加症、貧血、ESRの増加が明らかになります。一般的な尿分析の変化は、腎アミロイドーシス(タンパク尿)の追加を特徴とする重度の形態で現れます。 生化学的血液検査は、低タンパク血症、低アルブミン血症、α-グロブリンの増加、鉄、ビタミンBの含有量の減少を明らかにします12、葉酸、亜鉛、マグネシウム、カリウム。 スカトロ検査のデータにより、病変のレベルを間接的に評価することができます。 プロセスの小腸局在化を伴うコプログラムでは、ポリフェカル、脂肪便、クリエーターが見られます。 結腸と - 粘液、白血球、赤血球の混合物。 X線診断により、腸内の病理学的プロセスの局在化と有病率を確立できます。 影響を受けた腸の領域は、変化していない腸の領域と交互になります。 変更されたループは硬くなり、画像はモザイク状になり、小さな充填欠陥があり、ポケットの形で腸壁を越えてコントラストが浸透します。 患部の腸は、偽憩室の形成とともに、細かく縁取られた特徴を獲得します。 腸壁の収縮能力が低下するか完全に失われると、バリウムの排出が遅くなります。 腸管腔の不均一な狭小化が観察され、その結果、非常に狭くなり、レースの形になります。 狭窄域の上では、腸が拡張します。 内視鏡診断は、診断の検証において決定的に重要です。 クローン病の場合、最も特徴的なのは、胃の前庭部と十二指腸の最初の部分の変化です。 内視鏡的に、腫瘍の狭窄に似た前庭部の円形の狭窄を検出することが可能です。 クローン病の初期は、内視鏡データが乏しいという特徴があります。白っぽい肉芽に囲まれた、アフタ型のびらんが見える鈍い粘膜です。 血管パターンがないか、滑らかになっています。 腸の内腔とその壁には、化膿性粘液が認められます。 臨床的寛解では、記載された変化が完全に消失することがあります。 病気が進行するにつれて、粘膜は不均一に厚くなり、色が白っぽくなり、大きな表面的または深い亀裂が認められます。 腸管腔が狭くなり、大腸内視鏡を進めるのが困難になります。 結腸内視鏡検査では、結腸の任意の部分および回腸末端の粘膜の標的生検を行うことができます。 クローン病では、病理学的プロセスは粘膜下層で始まるため、生検は粘膜下層の一部が生検材料に入るように実行する必要があります。 上記に関連して、症例の 54% で、疾患の形態学的基質が検出されません。 クローン病は、非特異性潰瘍性大腸炎、消化管結核、虚血性大腸炎、ホイップル病、憩室症、偽膜性大腸炎、リンパ肉芽腫症、原発性小腸アミロイドーシス、慢性腸炎と鑑別する必要があります。 これらすべての疾患に共通するのは、腸消化不良症候群およびいくつかの全身性病変です。 しかし、潰瘍性大腸炎は、結腸の遠位部分の変化を特徴とし、その過程で直腸とS状結腸が強制的に関与します。 非特異的潰瘍性大腸炎では、病変のセグメンテーションはありません。 クローン病よりも頻度は低く、全身症状が決定され、吸収不良症候群はそれほど顕著ではありません。 ただし、クローン病の最も正確な診断は、対象を絞った生検による内視鏡検査によって確認されます。 胃腸型の結核は、回腸に頻繁に局在すること、灰色がかった内容物で満たされた隆起した剥離した縁を有する潰瘍の検出を可能にする内視鏡所見によってクローン病と区別されます。 このような潰瘍は、クローン病では観察されない短い瘢痕の形成で治癒します。 高齢者では、クローン病と虚血性大腸炎を区別する必要があります。 後者の場合、食事後の腹部の激しい痛みの発作は、脾臓の屈曲、下行結腸、およびS状結腸における典型的な、虹彩鏡で検出可能な大腸炎の変化です。 虚血性大腸炎の最も重要なX線写真の兆候は、「指紋」症状です。 内視鏡検査および形態学的検査により、虚血性大腸炎のヘモジデリン含有細胞および生検材料の線維症に典型的なことが明らかになります。 リンパ肉芽腫症および原発性腸アミロイドーシスの診断は、組織学的検査に基づいて行われます。 最初のケースでは、腸間膜リンパ節からの生検標本にベレゾフスキー-スタンバーグ細胞が見られ、XNUMX番目のケースでは、直腸粘膜にアミロイドの沈着があります。 治療。タンパク質、ビタミン、微量元素を多く含む、機械的および化学的に穏やかな食事が処方されますが、牛乳に耐性がない場合は牛乳を除外し、粗い植物繊維を制限します。液体の経腸加水分解物の使用が指示されています。 サラゾ製剤とコルチコステロイドは、病原性薬物療法の基礎を形成します。 薬物の3日量は6〜XNUMX gで、大腸の病理学的プロセスの局在化により、スルファサラジンの活性はプレドニゾロンの活性を上回ります。 スルファサラジンの使用の効果がない場合、主に小腸の病変と免疫炎症の顕著な徴候がある場合、および疾患の全身症状がある場合は、コルチコステロイドの使用が示されます。 それらの使用の効果は、治療開始から最初の8週間で注目されます。 プレドニゾロンは、次のスキームに従って処方されます。増悪の高さで、60日あたり6 mg、その後、用量は徐々に減少し、10〜5週目までに、10日あたり52〜6 mgの維持用量に調整されます。 臨床的寛解に達すると、薬物は徐々に中止されます。 寛解が得られない場合、プレドニゾロンによる治療は外来で 0,05 週まで続けられます。 病気の重度の経過では、トルピッドカレント直腸膣、皮膚腸、腸腸フィステルの形の合併症の場合、2 gで3日10〜3回経口で6-メルカプトプリンの予約が75日間のコースで示されます臨床的寛解が達成されるまで3日間の間隔。 その後、年間を通じて維持量の薬を服用するように切り替えます。 この場合の4-メルカプトプリンの投与量はXNUMX日あたりXNUMXmgです。 免疫抑制剤による治療の効果は、XNUMX〜XNUMXか月後までに決定できます。 クローン病の治療における広範な使用は、メトロニダゾールによって発見されました。その主な適応症は、肛門周囲の瘻孔および亀裂、サラゾ製剤およびグルココルチコイドの効果の欠如、ならびに直腸切除後の疾患の再発です。 薬は500日あたり1000〜4 mgの用量で処方されます。 継続コースの期間はXNUMX週間を超えてはなりません。 クローン病の対症療法は、止瀉薬(イモジウム、ロペラミド)の短期コース(各2〜3日)の予約に短縮されます。 投与量は、臨床効果に応じて個別に選択されます。 長期間(5日以上)止瀉薬を処方しないでください。 クローン病には吸収不良症候群が存在するため、胆汁酸を含まない酵素製剤(パンクレリパーゼ、メシンフォルテ、ソリジム、ソミラーゼ)は、2回の食事で6〜XNUMX錠の用量で使用されます。 適応症によると、貧血と低アルブミン血症は、鉄分製剤を(非経口的に)処方し、アルベジン、タンパク質加水分解剤、アミノペプチド、アミノ血液を投与することによって修正されます。 マルチビタミンを錠剤に、エッセンシャルをカプセルに割り当てます。 腸内毒素症の治療は、一般的な規則に従って行われます。 予後と予防。クローン病では、タイムリーな診断と効果的な経過観察により生命予後は良好ですが、仕事に関しては予後が不確かです。重篤な疾患を有する患者では、合併症および全身症状が存在する場合、障害グループ I または II が確立されます。クローン病は前がん性疾患です。患者は病気の経過の特徴を詳細に理解し、起こり得る合併症について警告し、その臨床症状をわかりやすい形式で説明する必要があります。 レクチャーNo.14。消化管の病気。 結腸の病気。 非特異的潰瘍性大腸炎 非特異的潰瘍性大腸炎は、潰瘍性破壊的変化を伴う結腸の粘膜に影響を与える炎症性疾患であり、慢性的な再発の経過をたどり、生命を脅かす合併症の発症を伴うことがよくあります。 病因と病因。非特異的潰瘍性大腸炎は特発性疾患です。その発生理由は不明です。 病気の起源を説明する多くの理論(感染性、酵素性、アレルギー性、免疫性、神経性など)の中で、感染性理論は最も興味深いものですが、結腸の内容物から病原体を分離する試みは成功しませんでした。 慢性潰瘍性大腸炎の病理学的プロセスは、直腸で始まり、近位方向に広がり、結腸の上にある部分を捉えます。 炎症は、直腸 (直腸炎)、直腸および S 状結腸 (直腸 S 状結腸炎) に限定されるか、左側のセクション全体 (左側大腸炎) に広がるか、結腸全体 (全大腸炎) に影響を及ぼします。 機能面では、非特異的大腸炎の結腸の長さは約 1/3 に減少します。 病理学的物質の研究では、結腸の粘膜のびまん性炎症が明らかになりました(顕著な腫れと過多、ひだの肥厚)。 さまざまなサイズの潰瘍が粘膜に形成され、不規則な形状をしており、その底部は粘膜にあり、粘膜下層、筋肉および漿膜にあります。 形態学的には、初期に、多形核白血球の混合物を含むリンパ球、血管の拡張、およびこれらの血管の内皮の腫脹からなる粘膜固有層の浸潤が決定されます。 微小循環の違反は、粘膜上皮の構造と機能の違反を悪化させる低酸素症の発症を伴います。 顕著な臨床症状の段階には、上皮の表層への白血球浸潤、陰窩の内腔に好中球の蓄積が起こる陰窩炎の発症が伴います。 陰窩の遠位部分が消失し、陰窩膿瘍が形成され、その形成において上皮細胞の成熟障害が重要な役割を果たします。 陰窩の内側を覆う上皮の壊死により、陰窩膿瘍が開き、潰瘍が形成されます。 寛解期間中、粘膜は回復しますが、その萎縮、陰窩の変形、固有層の不均一な肥厚が残ります。 分類 (Yu。V. Baltaitis et al。、1986)。 臨床的特徴。 1.臨床形態: 1)急性; 2) 慢性。 2.現在: 1) 急速に進行している。 2) 継続的に再発する。 3)再発; 4) 潜在的。 3.活動度: 1) 悪化; 2) 衰弱増悪; 3) 寛解。 4.重大度: 1) 光; 2) 中等度; 3) 重い。 解剖学的特徴。 1.巨視的特徴: 1) 直腸炎: 2) 直腸S状結腸炎; 3) 小計病変; 4) 全敗。 2.微視的特性: 1)破壊的炎症過程の優勢; 2)修復の要素による炎症過程の減少; 3) 炎症過程の結果。 1.ローカル: 1) 腸の出血; 2) 結腸の穿孔; 3) 結腸の狭窄; 4) 仮性ポリポーシス; 5) 腸の二次感染; 6)粘膜の消失; 7) 結腸の毒性拡張; 8)悪性腫瘍。 2.一般: 1) 機能性皮質機能低下症; 2) 敗血症; 3) 全身症状 - 関節炎、仙腸炎、皮膚病変、虹彩炎、アミロイドーシス、静脈炎、硬化性胆管炎、肝ジストロフィー。 臨床画像。潰瘍性大腸炎の臨床像は多型的であり、経過の重症度とプロセスの重症度によって異なります。炎症過程は慢性と考えられることが多いですが、場合によっては急性になります。結腸への損傷の程度も異なる場合があります。非特異的潰瘍性大腸炎は、排便時の緋色の血の排出、腸の機能不全、腹痛という 3 つの主な症状によって特徴付けられます。 排便中の血液の分離(糞便の表面の筋から300ml以上まで)は、この病気の最初の徴候です。 この病気の急性型では、ジェットによって血液が分泌され、虚脱や出血性ショックが発生するまで血圧が低下します。 腸の機能不全は、粘膜への広範な損傷と水と塩の吸収の減少の結果である、不安定な便が繰り返されるという苦情の形で現れます。 ほとんどの場合、下痢は重度の潰瘍性大腸炎で発生します。 ただし、下痢はプロセスの重症度の信頼できる指標ではありません。 便中の赤血球の存在と組み合わせた下痢の重症度が重要です。 かなりの数の潰瘍性大腸炎患者では、形成された糞便の表面に定期的に血液と粘液が見られ、これはしばしば痔の症状と誤って見なされます。 患者は、下腹部または左腸骨領域に局在することが多いけいれん性または持続性の下腹部の痛みを訴え、排便行為の前に増加し、排便後に消失します。 テネスムスがしばしば指摘される。 腸の粘膜下層、筋肉層、漿液層がプロセスに関与すると、痛みが増します。 腹部の触診は、前腹壁の筋肉の防御に現れます。 非特異性潰瘍性大腸炎の軽度の経過は、患者の満足のいく状態によって特徴付けられます。 腹部の痛みは中等度で短期間です。 椅子は2日に3〜2回装飾され、スピードアップされます。 便の中に血と粘液が混じっています。 このプロセスは、直腸および S 状結腸内に局在しています。 臨床経過は再発性です。 サラゾ製剤による治療効果は満足のいくものです。 再発は年に2回以下です。 寛解期間は長くなる可能性があります (3 ~ XNUMX 年以上)。 患者に下痢がある場合、中等度の病気の経過が診断されます。 椅子は頻繁に(6日に最大8〜38回)、各部分に血液と粘液の混合物が見られます。 腹部の痙攣痛がより激しくなります。 XNUMX℃までの体温上昇を伴う断続的な発熱、激しい全身衰弱があります。 病気の腸外症状(関節炎、ぶどう膜炎、結節性紅斑)もあるかもしれません。 コースは継続的に再発し、サラゾ製剤の効果は不安定であり、増悪時にホルモンが処方されます。 この病気の重症型は、急性発症を特徴としています。 病理学的過程が腸壁の奥深くまで広がると、大腸の全病変が急速に進行する。 患者の状態は急激に悪化します。 診療所の特徴は、突然の発症、高熱、24 日に XNUMX 回にも及ぶ大量の下痢、大量の腸出血、脱水症状の急速な増加です。 頻脈が現れ、血圧が低下し、非特異的な潰瘍性大腸炎の腸外症状が増加します。 保存的治療は必ずしも効果的ではなく、緊急手術が必要になることがよくあります。 診断と鑑別診断。軽度の病気の臨床血液検査では、軽度の好中球性白血球増加症、ESRの増加、赤血球数は変化しません。経過の重症度が増し、増悪期間が長くなるにつれて、混合起源の貧血が発生します(B12-欠乏および鉄欠乏)、ESRの増加。 中程度および重度の形態の血液の生化学的分析では、異常タンパク質血症、低アルブミン血症、高ガンマグロブリン血症、電解質の不均衡、および酸塩基状態が注目されます。 尿の一般的な分析では、アミロイドーシスを背景にネフローゼ症候群の形で合併症が発生した場合、尿検査に特徴的な変化がある場合にのみ変化が現れます-タンパク尿、「死んだ」尿沈渣、血液の増加そしてクレアチニン、尿素のレベル。 非特異的潰瘍性大腸炎では結腸粘膜が主に影響を受けるため、診断における主な役割は、標的生検を伴う内視鏡検査によって得られます。 直腸は常に病理学的プロセスに関与しています。つまり、S状結腸鏡検査中の肛門括約筋のすぐ後ろの内視鏡検査中にびらん性および潰瘍性の変化が検出されます。 潰瘍性大腸炎では、重度のけいれんのために、直腸 S 状結腸の屈曲を常に克服できるとは限りません。 直腸鏡のチューブを保持しようとすると、激しい痛みが伴います。 この場合、直腸鏡は 12 ~ 15 cm の深さまで挿入する必要があります。 非特異的潰瘍性大腸炎の重度の悪化中の結腸内視鏡検査は、実施するのが安全ではありません。 悪性腫瘍のリスクが高い場合に使用する必要があります。 S状結腸鏡検査の情報量が多いことに注意してください。 内視鏡画像は、疾患の形態によって異なります。 軽度の形態で、浮腫性の鈍い粘膜、腸壁の粘液の厚い白っぽいオーバーレイ、およびわずかな接触出血が見られます。 粘膜下層の血管パターンは視覚的に決定されません。 病気の中等度の経過では、粘膜の充血および浮腫、重度の接触出血、出血、びらんおよび不規則な形の潰瘍、腸の壁上の粘液の厚いオーバーレイが明らかになります。 病気の重篤な経過では、結腸の粘膜がかなりの範囲で破壊されます。 粒状の出血性の内面、線維性沈着物を伴う広範囲の潰瘍、さまざまなサイズと形状の偽ポリープ、腸管腔内の膿と血液が見られます。 大腸内視鏡検査およびS状結腸鏡検査の禁忌は、疾患の急性期における重度の潰瘍性大腸炎です。 X線検査では、病変の範囲を判断できます。 説得力のない内視鏡検査データの場合の診断を明確にする。 クローン病、憩室疾患、虚血性大腸炎との鑑別診断; 悪性の兆候をタイムリーに検出します。 単純X線写真では、腸の短縮、穿孔の欠如、中毒性の拡張、穿孔中の横隔膜ドームの下の遊離ガスが明らかになる場合があります。 虹彩鏡検査は細心の注意を払って実施する必要があります。 患者の状態の悪化を引き起こす可能性があります。 場合によっては、浣腸と下剤を含むバリウム浣腸のための患者の準備を、研究の2日前に処方された特別な食事に置き換える必要があります. 場合によっては、造影剤浣腸を使用すると、穿孔が加速したり、結腸の毒性拡張を引き起こしたりする可能性があります。 したがって、急性現象の沈静後に虹彩鏡検査が行われます。 この方法は、粘膜の不均一性と「ざらつき」、腸壁の肥厚、潰瘍、偽ポリポーシス、腸閉塞の欠如を明らかにします。 非特異性潰瘍性大腸炎の鑑別診断は、主に急性腸感染症で行われます。 腸感染症の流行が存在する場合、診断は簡単に確立されます。 しかし、急性腸感染症の散発的な病的状態の場合でさえ、潰瘍性大腸炎は再発する経過をたどる一方で、大腸炎症候群は再発することなく流れます。 急性腸管感染症を特定するための最も正確な方法には、細菌学的および血清学的が含まれます。 多くの場合、潰瘍性大腸炎はクローン病と区別されます。 典型的な場合、クローン病は、直腸への損傷、病理学的過程における回腸の頻繁な関与、および腸壁の分節性病変がないという点で、非特異的大腸炎とは異なります。 確定診断は、生検標本でクローン病に特異的なリンパ性肉芽腫を検出することによって行うことができます。 肉芽腫性大腸炎では、非特異的潰瘍性大腸炎よりも傍直腸炎および傍直腸瘻がより頻繁に検出されます。 場合によっては、潰瘍性大腸炎と腸結核を区別する必要があります。 腸結核の場合、プロセスの特定の局在化は特徴的(回腸、回盲部)、部分的な腸の損傷です。 しかし、腸結核では、直腸と大腸全体が影響を受けることがあります。 腸結核の大腸内視鏡画像は、灰色がかった内容物で満たされた縁が盛り上がった潰瘍の存在によって特徴付けられます。 結核性潰瘍は、横方向に広がり、潰瘍が再発する短い瘢痕を残す傾向があります。 非特異性潰瘍性大腸炎では、以前の潰瘍の部位に瘢痕が形成されません。 高齢者や老人患者では、潰瘍性大腸炎は虚血性大腸炎と区別する必要があります。 後者は、食事の20〜30分後に腹部に激しい発作性の痛みがあり、潰瘍性大腸炎では排便前に痛みが発生することを特徴としています。 最も重要な放射線の兆候は「指紋」の症状です。 虚血性大腸炎の内視鏡画像は、病変のはっきりと定義された境界、粘膜下出血、腸管腔に突き出たシアン化偽ポリポース形成によって特徴付けられます。 組織学的検査により、ヘモジデリン含有細胞と線維症が明らかになります。 生検時に接触出血がないことも、虚血性大腸炎をより示しています。 治療。単一の病因が存在しないこと、および非特異的潰瘍性大腸炎の病因が複雑であるため、この疾患の治療は困難になっています。抗炎症作用と抗菌作用のある薬が使用されます:サラゾピリダジン、スルファサラジン、サラゾジメトキシン、サロフォーク。経口摂取されたスルファサラジンは、腸内細菌叢の関与により、5-アミノサリチル酸とスルファピリジンに分解されます。未吸収のスルファピリジンは、クロストリジウム菌やバクテリオデス菌など、腸内の嫌気性微生物叢の増殖を阻害します。そして、5-アミノサリチル酸のおかげで、この薬は腸内細菌叢に変化を引き起こすだけでなく、免疫反応を調節し、炎症過程のメディエーターをブロックします。この薬は、活動的な炎症の全期間にわたって、2日あたり6〜1 gの用量で処方されます。大腸炎症候群が治まると、スルファサラジンの用量を徐々に減らして維持量に戻します(1,5日あたり平均XNUMX〜XNUMX錠)。 5-アミノサリチル酸誘導体(サロファルク、メサコール、サロサン、チジコール)の指定が基本的な方法であり、軽度および中等度の潰瘍性大腸炎の単剤療法として使用できます。 治療は、食事中のタンパク質、脂肪、炭水化物、ビタミンのバランスの取れた含有量の存在下で、乳製品を除いて食事療法の背景に対して行われます。 新鮮な果物、野菜、缶詰を除外することをお勧めします。 食品は、機械的および化学的に穏やかでなければなりません。 4日5~XNUMX回、少しずつ与えてください。 ビタミンの不均衡は、微量元素の吸収プロセスを混乱させ、錠剤(「Duovit」、「Oligovit」、「Unicap」)の複雑な製剤の指定によって補償されます。 軽度および中等度の病気の経過をたどる人の重度の下痢症候群では、サンドスタチンの任命が示されます。これは、胃腸ホルモンおよび生体アミン(血管作動性腸ペプチド、ガストリン、セロトニン)の合成を阻害します。潰瘍性大腸炎とクローン病。 また、薬は分泌を減らし、腸での吸収を改善し、内臓の血流を阻害し、運動性を低下させます。 サンドスタチンを使用すると(7日以内に0,1mgを2回皮下投与)、下痢が減少し、テネスムスが実質的に消失し、糞便による血液排泄が減少します。 重度の非特異性潰瘍性大腸炎では、非経口栄養を背景に治療が行われます。 これらの製剤のタンパク質含有量は、体重 1,5 kg あたり約 2,0 ~ 12 g である必要があります。 非経口投与されるコルチコステロイドは、重症型の疾患の病原性治療です。初日は、プレドニゾンが90時間間隔で静脈内投与され(120〜5 mg以上)、次の40日間は筋肉内に投与されます。徐々に投与量を減らします。 プラスの効果で、彼らは経口薬に切り替えます(XNUMX日あたりプレドニゾロンXNUMX mg). 安定した寛解期間中のホルモンの長期投与は実際的ではありません。 重度の病気の経過をたどった患者では、高圧酸素療法(HBO)のプラスの効果が認められました。 寛解期間中にHBOのコース(7〜10回の手順)を使用すると、再発の頻度を減らすことができます。 緊急外科的治療の適応症:腸穿孔、毒性拡張、大量の腸出血、悪性腫瘍。 非特異的な潰瘍性潰瘍の中程度の形態では、繊維、乳製品、および高タンパク質含有量の制限を伴う厳格な食事が必要です。 プレドニゾロンは、20 日あたり 40 ~ 1 mg の初期用量で経口投与されます。 治療は、スルファサラジンとその類似体で補うことができます。これらは、経口で摂取するか、マイクロクリスターや坐剤で直腸に投与します。 スルファサラジンの初回投与量は4日6gで、その後XNUMX〜XNUMXgに増量されます。 治療の補助的な方法として、抗炎症および止血効果のあるハーブの煎じ薬(バーネットの根、イラクサの葉、地衣類、灰色ハンノキの円錐形、甘草の根)を使用できます。寛解。 予後と予防。重症の場合、全身および局所の合併症が存在する場合、予後は重篤です。患者はまったく働くことができません。軽度および中等度の疾患では、生命予後は良好です。患者は軽作業に移される必要がある。 寛解期には、サラゾ製剤、細菌剤、心理療法、食事療法による維持療法が推奨されます。 潰瘍性大腸炎に長期間(5〜7年以上)苦しんでいる患者は、腸癌の発生のリスクグループに割り当てられ、診療記録を残す必要があります。 これらの患者は、対象を絞った生検を伴う結腸内視鏡検査が年に1回行われます。 LECTURE No. 15. 腎臓の病気。 急性糸球体腎炎 急性糸球体腎炎(AGN)は、糸球体に限局する感染性アレルギー性の急性びまん性腎疾患です。 AGNは、独立した疾患(原発性)または別の疾患の一部として続発性である可能性があり、後者の臨床像と診断を複雑にします。 AGNは通常、若年および中年の男性に影響を及ぼします。 病因。 AGN は、球菌感染症(インフルエンザ、急性扁桃炎、いわゆる腎炎原性微生物株によって引き起こされる咽頭炎)の後に最も頻繁に発生します。 患者の 60 ~ 80% で、グループ A β 溶血性連鎖球菌が検出されます; 症例の 1/3 では、AGN の病因を確立できません。 特に高湿度の条件下での長時間の低体温は、AGN の発症に寄与します。 ワクチン接種も病気の発症の要因であり、症例の 75% で XNUMX 回目または XNUMX 回目の注射後に腎臓が影響を受けます。 病因。この病気の発症には免疫機構があります。抗原(連鎖球菌、薬用、外来タンパク質)が体内に侵入すると、それに反応して抗体が形成され、これらの抗原に結合し、補体の第 3 画分とともに血管内を循環する免疫複合体を形成します。ベッド。この複合体は糸球体毛細血管の基底膜の外側に沈着し、補体分解産物の放出によって損傷を引き起こし、毛細血管の透過性を高め、毛細血管に局所的な変化を引き起こす可能性があります。好中球は免疫複合体の沈着部位に殺到し、そのリソソーム酵素が内皮と基底膜の損傷を悪化させ、それらを互いに分離します。血小板脱顆粒はセロトニンの放出を引き起こし、基底膜上での血液凝固とフィブリン沈着を引き起こします。 体からの免疫複合体の除去は、メサンギウム細胞および内皮細胞の増殖という形のマクロファージ反応によって促進され、このプロセスの有効性により、回復が起こります。 臨床画像。この病気の臨床像は次の症候群で構成されます。 尿路症候群。 1.糸球体の毛細血管壁の空間をタンパク質分子が通過することによるタンパク尿症で、免疫複合体が糸球体に沈着する際に形成されます。 タンパク尿は本質的に選択的であり、主にアルブミンが糸球体の「フィルター」を通過します。 2.毛細血管メサンギウムおよび間質組織の病理学的過程への関与による血尿。 赤血球は基底膜の最小の切れ目を貫通し、その形状を変化させます。 3.Cylindruria-尿細管の円柱状細胞の尿中排泄。 腎上皮の崩壊した細胞の尿細管におけるジストロフィー過程の間に、密な顆粒状の塊からなる顆粒状の円柱が形成される。 ワックス状のシリンダーは、鋭い輪郭と均質な構造を持っています。 ヒアリンキャストはタンパク質性の形成物です。 高血圧症候群は、次の理由で観察されます。 1) ナトリウムと水分の保持; 2) レニン-アンギオテンシン-アルドステロンおよび交感神経副腎系の活性化; 3) 腎臓の抑制系の機能の低下。 浮腫症候群は、次の要因に関連しています。 1) それらの敗北による糸球体濾過の減少; 2) ナトリウムのろ過電荷の減少とその再吸収の増加; 3)体内のナトリウム貯留による水分貯留。 4)BCCの増加。 5)二次性高アルドステロン症; 6) ADH の分泌が増加し、それに対する遠位ネフロンの感受性が増加し、体液貯留につながる。 7)毛細血管壁の透過性の増加および組織への血漿の放出。 8)大量のタンパク尿を伴う血漿膠質浸透圧の低下。 AGNで提示される苦情は特定のものではなく、さまざまな病気で発生します。 既往歴において、最近の喉の痛み、慢性扁桃炎の悪化、低体温症などを示すことは非常に重要です。一部の患者は、朝の顔の腫れ(ペースト状)と相まって、尿量の減少に気づきます。 病気の最初の日の1/3-3 / 4の患者では、腎臓のサイズの増加に関連する腰部の痛みはそれほど強くありません。 倦怠感、頭痛、運動中の息切れ、体温の短期間の上昇から亜熱性への上昇もあります。 患者の半数でのみ検出される動脈性高血圧は、140-160 / 85-90mmHgへの数の増加を特徴としています。 美術。 (まれに-最大180/100 mm Hg。Art。) 診断法。 100%のケースで、尿検査により、さまざまな重症度のタンパク尿、円筒尿、そして診断に最も重要なことである、微小血尿(視野内に最大10個の赤血球)から巨視的血尿(非常にまれではあるが)まで、さまざまな重症度の血尿が明らかになります。 )。ただし、AGN が疑われる場合は、尿の単一部分では赤血球が検出されない可能性があるため、一連の反復尿検査を実施するか、ネチポレンコ テスト (1 μl 中の形成要素の数を測定) を実施する必要があります。 血液を検査すると、急性期の指標が検出されます(フィブリノーゲンとαの含有量の増加2-グロブリン、C反応性タンパク、赤沈亢進)、白血球数の変化はほとんどなく、中等度の貧血。 AGNの複雑でない経過では、血中の窒素物質(クレアチニン、インディカン、尿素)の含有量は変化しません。 病気の初期段階では、Reberg テストの変化が観察されます - 糸球体濾過の減少と尿細管再吸収の増加で、回復するにつれて正常化します。 重度の動脈性高血圧症の患者の X 線検査では、左心室に中等度の増加が見られる場合があり、患者の回復と同じ大きさになります。 AGNには3つの臨床的変異があります。 1) 単症候性バリアント: 軽度の愁訴、浮腫および動脈性高血圧症の欠如、尿路症候群のみがあります。 病気の経過の最も一般的な変種(症例の86%)。 2)ネフローゼ変異:浮腫、乏尿が顕著で、血圧を比較的低い数値に上げることが可能であり、患者の8%で検出されます。 3)拡張バージョン:動脈性高血圧、高い数値(180/100 mm Hg。Art。)、中程度に顕著な浮腫、循環虚脱が6%の症例で発生します。 差動診断。 AGN は慢性糸球体腎炎と区別する必要がありますが、AGN は急性に発症し、その後症状が完全に回復するため、困難ではありません。しかし、急性の発症がない場合や、病気の特定の兆候が長期間持続する場合、診断は大幅に複雑になります。鑑別が難しい場合は、腎臓の穿刺生検が行われます。 両方の疾患に白血球尿が存在するため、AGNと腎盂腎炎を区別することは困難です。 ただし、AGNには、より大量のタンパク尿と、場合によっては浮腫が伴います。 鑑別診断はまた、発熱と運動障害を伴う腰痛のより顕著な痛みの形での腎盂腎炎の臨床症状によって助けられます。 また、腎盂腎炎における細菌尿の定義、「活動性」白血球の同定、X線(カップの変形)および同位体レノグラフィック(腎機能の非対称性)研究も診断的価値があります。 独立した疾患としてのAGNは、AGNが疾患の症状のXNUMXつである慢性びまん性結合組織病と区別する必要があります。 この状況は通常、尿、高血圧、浮腫性症候群の重症度と、病気の他の症状の明確さが不十分な場合に発生します。多くの場合、SLE(全身性エリテマトーデス)が発生します。 SLEでの正しい診断は、関節症候群、皮膚や他の臓器(心臓)の損傷、顕著な免疫学的変化(高力価の抗臓器抗体、エリテマトーデス細胞、DNAおよびRNAに対する抗体の検出)を考慮に入れることによって行うことができます。 )、および臨床像のダイナミクスを監視します。 治療。 AGN の治療は複雑で、次のような対策が含まれます。 1.モード。 AGNが疑われる場合、または診断が確定した直後に、患者は直ちに入院する必要があります。 浮腫がなくなり血圧が正常になるまで、約2〜4週間は厳密な安静を観察する必要があります。 ベッドにとどまると、体が均一に温まり、血管痙攣が減少し(したがって、血圧が低下し)、糸球体濾過と利尿が増加します。 退院後、発症日から最長4ヶ月間在宅治療が適応となり、AGNの慢性期への移行を予防するのに最適です。 2.ダイエット。 臨床症状の重症度に応じて、水分と塩化ナトリウムを制限することが非常に重要です。 拡張されたネフローゼ型の場合、利尿に等しい量の水分摂取で1〜2日間完全に断食することをお勧めします。 2〜3日目には、カリウム塩が豊富な食品(お粥、じゃがいも)の摂取量が表示されます。 300日あたりに飲まれる水の総量は、前日に割り当てられた尿の量に500〜3mlを加えたものに等しくなければなりません。 4〜60日後、患者はタンパク質制限のある食事療法(3日あたり最大5g)に移され、塩の総量はXNUMX〜XNUMXg/日以下です。 このような食事療法は、腎外症状がすべて消え、尿沈渣が急激に改善するまで推奨されます。 3.薬物療法には、まず抗菌療法が含まれますが、AGNの感染性が確実に確立されている場合にのみ実行する必要があります(病原体が分離され、発症から3週間以内に経過した場合)。疾患)。 通常、従来の投与量で処方されたペニシリンまたはその半合成類似体。 慢性感染症(扁桃炎、副鼻腔炎など)の明らかな病巣の存在も、抗生物質療法の直接的な兆候です。 AGNの治療における利尿薬は、体液貯留、血圧の上昇、および心不全の出現によってのみ示されます。 浮腫と高血圧がなくなるまで使用される最も効果的なフロセミド(40-80mg)。 これらの薬の長期処方の必要はありません、3-4用量で十分です。 浮腫はないが、高血圧が持続する場合、またはサル尿剤の降圧効果が不十分な場合、降圧薬(クロフェリン、ドペジット)は、動脈性高血圧の持続性に応じた投与期間で処方されます。 ネフローゼ型のAGNでは、免疫抑制療法が処方されます(コルチコステロイド-60日あたり120〜4 mgのプレドニゾン、その後徐々に用量を減らし、8〜XNUMX週間の使用期間)。 重度の浮腫と利尿の著しい低下を伴う AGN の場合、ヘパリンを 20 日 000 ~ 30 IU で 000 ~ 4 週間投与すると、血液凝固時間が 6 ~ 2 倍になります。 タンパク尿が長引くと、インドメタシンまたはボルタレンが75日あたり150〜XNUMX mgで処方されます(高血圧および乏尿がない場合)。 予後は良好ですが、長期の形態では、プロセスが慢性化する可能性があります。 AGNの予防は、局所感染の効果的な治療、合理的な硬化に帰着します。 ワクチン接種後の病気の発症をタイムリーに検出するために、すべての患者でARVIを転送するには、尿を検査する必要があります。 講義番号16。腎臓の病気。 腎盂腎炎 腎盂腎炎は、腎盂、その腎盂、および腎臓の物質がその過程に関与し、間質組織の主な病変を伴う感染症です。 この点で、腎盂腎炎は間質性(間質性)腎炎です。 これは、腎盂腎炎よりも広い概念です。 それは、第一に、間質の主な関与を伴うあらゆる病因の腎臓の炎症の一種であり、第二に、この炎症が唯一かつ主な発現である特別な疾患です. 間質性腎炎に近いのは、いわゆる尿細管間質性腎炎であり、尿細管と腎臓の間質の友好的な病変があります。 分類。臨床的および形態学的データに基づいて、急性腎盂腎炎と慢性腎盂腎炎が区別され、通常、急性腎盂腎炎の発作の形で再発性の経過をたどります。 また、腎盂腎炎は片側および両側に発生する可能性があります。 コースの形態によると(慢性腎盂腎炎の場合):再発形態、潜在的な慢性腎盂腎炎、腎盂腎炎のしわのある腎臓。 病因と病因。腎盂腎炎は感染症です。その原因物質は、大腸菌、腸球菌、ブドウ球菌、その他の細菌などの非特異的な性質の感染物質ですが、ほとんどの場合、大腸菌 (40%) と混合細菌 (38%) が話題になります。 慢性腎盂腎炎を引き起こす可能性のあるL型菌、プロトプラスト(細菌の体、感染をサポートできる膜がない)、カンジダに注目が集まっています。 感染源は、扁桃腺、生殖器および大腸の疾患である可能性があります。感染性病原体は、多くの感染症(腸チフス、インフルエンザ、狭心症、敗血症)。 多くの場合、微生物は、尿管、膀胱、尿道(尿路性上行性腎盂腎炎)から上向きに腎臓に運ばれます。これは、尿管と骨盤の運動障害、骨盤内圧の上昇(膀胱腎および腎盂腎逆流)によって促進されます。骨盤の内容物の腎髄質の静脈への再吸収(腎盂腎逆流)。 上行性腎盂腎炎は、原則として、尿の流出が困難な泌尿生殖器系の疾患(尿管の結石や狭窄、尿道狭窄、泌尿生殖器系の腫瘍)を複雑にするため、妊娠中に発症することがよくあります。 結腸と生殖器が感染源である場合、腎臓のリンパ性感染症(リンパ性腎盂腎炎)も可能です。 腎盂腎炎の発症には、腎臓への感染の浸透に加えて、体の反応性と、尿の流出と尿のうっ滞の違反を引き起こす多くの局所的な原因が非常に重要です。 同じ理由で、この疾患の再発性慢性経過の可能性が説明されています。 尿路の機能的および形態学的変化を伴う感染した微生物は、尿うっ滞、腎臓からの静脈およびリンパ管の流出の障害、腎臓の感染の固定に寄与し、炎症性浸潤の限局性および多形性ゾーンを引き起こし、間質の化膿を引き起こします。または両方の腎臓。 尿細管の間質組織が影響を受け、次にネフロンが影響を受けます。 生産性動脈内膜炎、血管の中殻の過形成、ヒアリン症の現象、細動脈硬化症が二次しわの寄った腎臓まで発生します。 近年、慢性腎盂腎炎の発症における特定の役割が自己免疫反応に割り当てられています。細菌抗原の影響下で、免疫グロブリンGと補体が糸球体毛細血管の基底膜に沈着し、その損傷を引き起こします。 急性腎盂腎炎から慢性腎盂腎炎への移行は、急性腎盂腎炎の診断の遅れ、早すぎる入院、慢性感染症の存在、糖尿病、痛風、鎮痛薬の乱用-フェナセチンによって促進されます。 慢性腎盂腎炎は女性(50%)でより一般的であり、これは妊娠、特に繰り返される妊娠(エストロゲンは尿路の平滑筋のアトニーを引き起こす)、尿路の構造に関連する少女の小児期に促進されます。 、それらの異常。 臨床画像。上で述べたように、腎盂腎炎は急性および慢性の両方の経過をたどる可能性があります。 病気の急性期の臨床像は、体温が39〜40℃まで急激に上昇し、脱力感、頭痛、悪寒が始まり、大量の発汗、吐き気、嘔吐が起こることがあります。 体温の上昇に伴い、腰部に痛みが現れますが、これは原則として片側に見られます。 痛みの性質は鈍く、その強さは異なります。 尿路結石症を背景に疾患が発症した場合、腎疝痛の発作が腎盂腎炎の発作に先行します。 適切な治療法がない場合、この疾患は慢性化する可能性があります。または、これが腎臓の化膿プロセスの発生につながります。これは、患者の全身状態の悪化と体温の急激な変化(35-36から朝の°Cから夕方の40-41°Cまで)。 慢性腎盂腎炎は、原則として、急性炎症を除去することができた場合、過小治療された急性腎盂腎炎の結果ですが、腎臓内のすべての病原体を根本的に破壊することも、腎臓からの尿の生理学的流出を回復することもできませんでした。 慢性腎盂腎炎は、湿った寒い気候で悪化する、腰部の鈍い痛みが絶え間なく続くことを心配しています。 また、慢性腎盂腎炎は、患者が急性過程のすべての兆候を持っている場合、定期的に悪化する傾向があります。 診断法。この病気の診断の問題は、腎盂腎炎の症状が尿路の炎症に起因する他の病気の症状と似ているという事実によるものです。 診断検査計画には、血液検査、尿検査、泌尿器系の状態を示す検査(腎臓の超音波検査、X線検査、感染因子のPCR分析)が含まれます。 感染性病原体の種類を確認するには、尿サンプルの細菌培養を行う必要があり、コンピューター断層撮影法を使用して腫瘍プロセスを除外します。 したがって、実験室および特別な研究方法は、病気の認識にとって非常に重要です。 そして、慢性腎盂腎炎では、決定的な、時には唯一の症状は、尿、血液、尿路の変化です. 患者の血圧と体重を動的に監視する必要があります。 白血球増加症、ESRの増加、好中球シフトが血中に見られ、残留窒素レベルの増加(標準20〜40 mg)、尿素(標準40〜60 mg)、クレアチニン(標準53〜106μmol/ l) )、インジカン(基準 1,41、3,76 ~ 180 µmol/l)、コレステロール(基準 200 ~ 83 mg)、血中塩化物(基準 XNUMX mmol/l)。 尿の変化の診断に重要です:比重の減少、タンパク尿(毎日を含む)、血尿および円柱尿。 しかし、尿沈渣の形成要素を定量的に測定する方法は、診断上の重要性が増しています。カコフスキー・アディス法(正常白血球は最大4万個、赤血球は最大1万個、シリンダーは2時間で最大24個)。アンバーガー (正常白血球最大 2000、赤血球最大 1400、キャスト - 20 分あたり最大 1)、ネチポレンコ (正常白血球最大 2500、赤血球最大 1000、キャスト - 20 ml あたり最大 1)出たばかりの尿)。 腎盂腎炎を伴う尿沈渣中の赤血球と白血球の絶対数の比率は、白血球の有意な優勢に向かって10〜20倍劇的に変化します。 慢性腎盂腎炎では、ステンハイマー・マルビン細胞が尿中に現れる:細胞質顆粒のブラウン運動を伴う大きな白血球、尿の浸透特性の低下(比重10-14未満)を伴って現れる、ゲンチアナバイオレットとサフロニンで青く染色され、 「活性」白血球:蒸留水を加えたメチレンブルーの1%水溶液で染色すると明らかになる、原形質のブラウン運動を有する変化した白血球。 「活性」白血球およびステンハイマー-マルビン細胞(最大40%)、細菌尿(尿100mlあたり1万を超える微生物数)、亜硝酸塩試験(微生物数がそれ以上)の増加の診断的価値100万U以上、微生物が尿中亜硝酸塩を分解する)が強調されています。スルファニル酸とL-ナフチルアミンを添加すると、赤色が現れます)、比色TTXテスト(微生物デヒドロゲナーゼの作用下で、トリフェニルテトラゾライトクロリドは赤色の不溶性に還元されます) -4°Cの温度で10-37時間以内のトリフェニルホルマザン)、挑発的なプレドニゾロンテスト(患者は無菌皿に収集し、尿の中央部分は対照のものであり、次に30mlの生理食塩水中の10mgのプレドニゾロンはゆっくりと静脈に注入され、尿の中央部分が24時間間隔でXNUMX時間後にXNUMX回収集されます。慢性腎盂腎炎では、白血球の数、細菌がXNUMX倍になり、「活動的な」白血球が少なくともXNUMXつの部分に現れます)、抗生物質。 腎臓の結核の顕微鏡検査(Tsilに従って染色された塗抹標本の顕微鏡検査、特別な培地に尿を播種する-生物学的方法であるPreisおよびShkolnikovaの方法)に特に注意を払う必要があります。 片側性のプロセスが疑われる場合は、特別なカテーテルを使用して各腎臓から個別に尿検査を実施する必要があります。 慢性腎盂腎炎の診断における重要な役割は、放射線学的研究方法によって果たされます:調査X線撮影および断層撮影(腎臓の位置、サイズおよび形状を特徴づける)、排泄および逆行性腎盂造影(腎臓の濃度および排泄能力の低下、痙攣) 、異常、骨盤の変形、蝸牛)、腎盂腎造影(非造影石の認識用)、腎血管造影(血管構造の違反を明らかにする-動脈と静脈)。 機能の安全性と腎臓の実質を決定するために、特に片側性のプロセスでは、レノグラフィー(ヒップランヨウ素131)およびスキャノグラフィー(ネオハイドライドHg 203を使用)などの放射線指示法が使用されます。 プロセスの病巣による腎盂腎炎の場合の穿刺生検は、情報を提供しない場合があります。 クロモシストスコピーは腎臓の損傷を示している可能性があります。 治療。ほとんどの場合、腎盂腎炎の治療は保守的ですが、急性腎盂腎炎が化膿性である場合は、外科的介入が必要になる場合があります。保存的治療は、腎臓と患者の体全体の機能を安定させるための養生法、食事療法、抗生物質の使用、およびさまざまな薬物の使用で構成されます。 急性腎盂腎炎では、厳密な安静が必要です。 食品は、最適な量のタンパク質、脂肪、炭水化物を含む食品を消費する必要があります。 急性期には、タンパク質と植物性食品を交互に使用する必要があります。 重度の中毒では、たくさんの水を飲む必要があります。 慢性腎盂腎炎の治療は、原発性腎盂腎炎の感染症(病因性)への影響と、続発性腎盂腎炎の何らかの原因の排除、病因メカニズム、および合併症の治療で構成されます。 最も効果的な治療法は、薬剤感受性を決定した後です。 抗菌薬による継続的(少なくとも2か月)の治療が行われます。 入院直後に、抗生物質、スルファニルアミドまたはニトロフラン薬が処方されます。 1〜10日後、薬剤を交換し、白血球尿と細菌尿が持続的に消失するまで治療を行います。 増悪が解消されるとすぐに、抗菌剤の4つによる断続的な治療が5〜7か月間行われます。薬は8日間投与され、その後10〜10日間休憩をとるか、薬が投与されます15〜20日の間隔で15日間、または薬を15日間投与し、XNUMX日間間隔をあけてから、抗菌療法を再度処方します。 治療期間と間隔は、臨床症状と実験室での管理によって決定されます。 慢性扁桃炎の患者に発症した腎盂腎炎の場合、ペニシリン系の抗生物質が最も効果的であり、男性と女性の生殖器感染症の場合、広域スペクトルの抗生物質が使用されることを指摘する必要があります (表 12 を参照)。 . グラム陰性菌の存在下では、ナリジクス酸による治療で良好な結果が得られます(黒、イエビグラモン-1,0 gを4日7回、2日間、ただしその製剤は他の薬剤よりも処方頻度を少なくする必要があります(1,0回))。 スルファニルアミド製剤から、エタゾール(4 g 10回-0,1日)、ソラフル(3 g 0,1回)、長時間作用型スルホンアミドが使用されます。 また、コースはフラゾリドン、フラドニン、フラギン(4gをXNUMX日XNUMX回)で治療されます。 治療を開始する前に腎機能を測定する必要があることを強調する必要があります。 長期の抗生物質療法は、少なくとも30 ml /分の糸球体濾過率、または70mg以下の血清中の残留窒素含有量で実施する必要があります。 10週間の治療後の薬の有効性の指標は、000mlの尿中の微生物数が1に減少することです。 10〜14日ごとに尿の反応を変えることで、微生物叢の病原性を減らし、抗菌剤の効果を高めることができます。 アルカリ化食品、クエン酸ナトリウム(10日あたりXNUMXg)、アルカリ性ミネラルウォーターは、pH反応を低下させるのに役立ちます. 一部の抗菌作用には、クランベリーやクマの実に豊富に含まれる安息香酸ナトリウム(4日あたり6〜XNUMX g)が含まれています。 病因療法は、体の反応性を高め、尿の流出を改善し、血圧を正常化することを目的とすべきです。 免疫生物学的反応性を活性化するために、α-グロブリン、自己血液療法、輸血、ワクチン療法(自己ワクチン治療は30〜40日間、皮下に0,1mlまたは0,2日ごとに0,3〜2ml)、ブドウ球菌トキソイド(0,1〜0,3〜 0,5日ごとに0,7-1,0-1,2-1,7-2,0-3ml)。 利尿薬草(ベアベリー、ジュニパーベリー、スギナ、オルソサイフォンの葉 - キドニーティー、コケモモの葉)、鎮痙薬(パパベリン、ノーシュパなど)は、尿の流出を正常化するのに役立ちます。 尿の流れに障害がある場合は、外科的治療が必要です。 付随する高血圧症では、イソバリン、ドペジット、ヘミトン、サルレティクス、アルドステロンアンタゴニストなどのラウウルフィア製剤が示されます。 予防と予後。 腎盂腎炎の予防は、一次的および二次的対策で構成されています。 一次予防には、まず第一に、腎盂腎炎の発症につながる可能性のある疾患の治療が含まれます:限局性感染症、泌尿器疾患(尿路結石症、前立腺腺腫など)、および尿の流出の違反を伴う疾患腎臓)、レクリエーション活動。 表12 腎盂腎炎における抗菌薬の有効性の比較
二次予防には、予防検査中の細菌尿の検出(たとえば、妊娠中の女性は少なくとも月に1回尿の細菌学的分析を行う必要があります)、抗再発治療の予約:毎月の最初の週 - 治療の一時停止:ローズヒップ煎じ薬、1週目、1,0週目 - ハーブ利尿薬および防腐剤、4週目 - 抗菌剤(ニトロフラン、抗生物質、防腐剤、年2回 - ネビグラモン5 gを週に100回、150 g - 4週目、または10 -NOC 12-XNUMX mg を XNUMX 日 XNUMX 回、XNUMX-XNUMX 日間)。 再発防止治療は2〜3年間行われます。 治療を伴う調剤検査は、年に3〜4回、または4〜6回実施する必要があります。 予報。予後は病気の段階によって異なります。 療養所治療。療養所リゾート治療は寛解期に適応され、特に泌尿器科手術後の続発性結石性腎盂腎炎患者(トルスカヴェッツ、サイルメ、ジェレズノヴォツク、ベレゾフスキーミネラルウォーター)に適応され、患者は低ミネラル水を摂取する。 高血圧、重度の貧血、明らかな腎不全の場合、療養所とスパでの治療は禁忌です。 腎盂腎炎の合併症はさまざまです。 急性腎盂腎炎では、化膿性プロセスの進行により、大きな膿瘍が融合して腎臓の癰が形成され、化膿性空洞と骨盤との連絡(腎盂腎症)、プロセスの線維性被膜への移行(腎盂腎炎)が起こります。 )および腎周囲組織(腎盂腎炎)。 急性腎盂腎炎は、尿うっ滞の状態での細菌の直接的な毒性効果の結果として発症する、ピラミッドの乳頭の壊死(乳頭壊死)によって複雑になる可能性があります。 腎盂腎炎のこの合併症は、ほとんどの場合、糖尿病患者に発生します。 まれに、腎盂腎炎が敗血症の原因になります。 瘢痕化期間中の化膿性プロセスの制限により、化膿性膜に囲まれた膿瘍(慢性腎臓膿瘍)が形成される可能性があります。 慢性腎盂腎炎、特に片側性腎盂腎炎では、XNUMX番目の(無傷の)腎臓に腎性高血圧と細動脈硬化症を発症する可能性があります。 腎臓の両側性腎盂腎炎のしわは慢性腎不全につながります。 急性腎盂腎炎の転帰は通常回復ですが、合併症(腎盂腎症、敗血症、乳頭壊死)の結果、死亡することがあります。 腎臓のしわを伴う慢性腎盂腎炎は、多くの場合、高窒素血症尿毒症で終わります。 腎起源の動脈性高血圧症の発症に伴い、慢性腎盂腎炎の致命的な結果は、高血圧症で発生する合併症(脳出血、心筋梗塞など)と関連している場合があります。 著者:Mostovaya O.S.
タッチエミュレーション用人工皮革
15.04.2024 Petgugu グローバル猫砂
15.04.2024 思いやりのある男性の魅力
14.04.2024
▪ 電話用望遠レンズ ▪ 色とりどりの光子 ▪ リピート付き電話
▪ 記事 彼らは長生きしましたが、同じ日に亡くなりました。 人気の表現 ▪ 記事 泥の中に端から落ちたコインによってイギリスの詩人はどのような決断を促されましたか? 詳細な回答 ▪ 記事 燃料ディスペンサー。 労働保護に関する標準的な指示 ▪ 記事 XNUMX段階の明るさ制御による色と音楽のセットアップ。 無線エレクトロニクスと電気工学の百科事典 ▪ 記事 電源が入ったときに無線機器を過負荷から自動的に保護します。 無線エレクトロニクスと電気工学の百科事典
ホームページ | 図書館 | 物品 | サイトマップ | サイトレビュー www.diagram.com.ua |






 Arabic
Arabic Bengali
Bengali Chinese
Chinese English
English French
French German
German Hebrew
Hebrew Hindi
Hindi Italian
Italian Japanese
Japanese Korean
Korean Malay
Malay Polish
Polish Portuguese
Portuguese Spanish
Spanish Turkish
Turkish Ukrainian
Ukrainian Vietnamese
Vietnamese








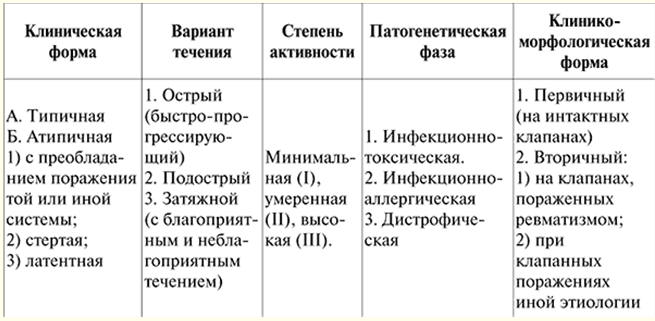








 他の記事も見る セクション
他の記事も見る セクション 